Die Primären Autoimmunerkrankungen der Leber sind die Autoimmunhepatitis (AIH), die Primär Biliäre Cholangitis (PBC) und die Primär Sklerosierende Cholangitis (PSC). Für die Differenzialdiagnostik stehen neben interventionellen Diagnosemöglichkeiten (Histologie, Radiologie) Tests zur Bestimmung sehr spezifischer Autoantikörper zur Verfügung.
Schlüsselwörter: Autoimmunhepatitis, Cholangitis, AMA, LKM, ANCA
Die Diagnose einer autoimmunen Lebererkrankung ist für die Betroffenen oft ein schwerwiegender Einschnitt im Leben, der eine lebenslange Therapie und im Extremfall eine Lebertrans- plantation in Aussicht stellt. Wie der Name vermuten lässt, gibt es wissen- schaftlich fundierte Hinweise auf eine ätiopathogenetische Beteiligung des Immunsystems; dennoch sind Forscher der genauen Ursache immer noch auf der Spur.
Die Symptomatik bei der Primärvor- stellung des Patienten ist oft unspezifisch. Sie reicht von Müdigkeit und Abgeschla- genheit bis zu Ikterus und Fieberschüben und bietet viele differenzialdiagnostische
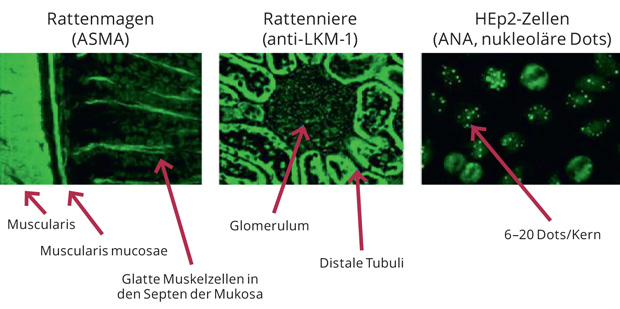
Möglichkeiten. Doch viel Zeit für Speku- lationen bleibt nicht, denn die Diagnose muss rasch gestellt werde, um vermeid- bare, irreversible, Schäden und Folgeer- krankungen zu vermeiden. Wegweisend ist dabei stets der Nachweis von Autoan- tikörpern (Abb. 1).