Die heute üblichen Gerinnungs-Globaltests stoppen bereits, wenn nur wenige Prozent des verfügbaren Thrombins gebildet wurden; alle nachfolgenden Prozesse bleiben unerkannt. Thrombinbildungs-Assays liefern hier ein weit umfassenderes Bild der Hämostase. Aus dem Kurvenverlauf kann man sowohl eine Blutungs- oder Thromboseneigung ablesen als auch Medikamentenwirkungen erkennen, die den herkömmlichen Gerinnungstests unzugänglich sind.
Schlüsselwörter: Globaltests, Thrombingenerierung, Aktivatoren, Inhibitoren, Antikoagulanzien
Bereits in den 1950er-Jahren wurde der gesamte zeitliche Verlauf der Gerinnselbildung nach Stimulation des Gerinnungssystems als mögliches Testprinzip untersucht. Allerdings geriet dieser Gedanke aufgrund des hohen technischen Aufwandes für die Quantifizierung des Fibrinogenumsatzes wieder in Vergessenheit. Einfachere Methoden, insbesondere PTZ und aPTT, bei denen lediglich die Zeit bis zum Eintritt der Fibrinbildung bestimmt wird, standen für lange Zeit als Routinemethoden im Vordergrund. Hierbei kamen unphysiologisch hohe Aktivatorkonzentrationen zum Einsatz, die kurze Messzeiten und hohe Reproduzierbarkeit ermöglichten.
Mit zunehmendem Verständnis der Abläufe im Gerinnungssystem von der initialen Aktivierung bis zur Clotstabilisierung und Fibrinolyse stieg ab den 1990er-Jahren der Bedarf an Methoden, die jeden einzelnen Prozess zuverlässig abbilden. Verstärkt wurde dieser Wunsch durch die Entdeckung genetischer Varianten, etwa der APC-Resistenz und der Prothrombinvariante 20210GA sowie der moderierenden Wirkung von prothrombotischen Mutationen auf die Blutungsneigung von Hämophiliepatienten. Auch die Wirkung neuerer Antikoagulanzien wie etwa der Pentasaccharide und Hirudine konnte mit den klassischen Assays nur unzureichend abgebildet werden. Deshalb entwickelte die niederländische Arbeitsgruppe um Coenraad Hemker den Thrombinbildungstest[1, 2], der den gesamten Gerinnungsprozess mit einem Fokus auf die Balance zwischen pro- und antikoagulatorischen Entitäten vollumfänglich abbildete.
Physiologische Aktivierung
Die Aktivierung erfolgt bei diesem Assay mit rekombinantem Tissue Factor in Konzentrationen von 0,5 bis 5 pmol/l; für die PTZ werden ca. 500 pmol/l verwendet. Bei sehr geringen Aktivatorkonzentrationen ist die Thrombinbildung auf die Feedback-Mechanismen über FVIII, FIX und FXI angewiesen, die nun im Test miterfasst werden können. Zu einem bestimmten Grad gehen auch die physiologischen Inhibitoren (Antithrombin, Protein S, Protein C und TFPI) in das Testergebnis mit ein, wenn man eine deutlich verlängerte Messdauer von 40 bis 120 Minuten akzeptiert. Um die physiologische Aktivierung möglichst naturgetreu zu imitieren, wird der Tissue Factor an Lipidvesikel gebunden zum Testansatz hinzugefügt. Das verhindert seine Denaturierung und Aggregation und verbessert die Reproduzierbarkeit der Ergebnisse.
„Ineffizientes" Substrat
Durch die stark verlängerte Messdauer werden herkömmliche Thrombinsubstrate während der Messung vorzeitig und vollständig verbraucht. Eine adäquate Erhöhung der Konzentrationen kommt nicht infrage; sie würde selbst modernste optische Messsysteme überfordern.
Bei der Suche nach synthetischen Ersatzstoffen schieden hochaffine Substrate ebenfalls aus, weil sie als kompetitive Inhibitoren gegenüber den physiologischen Substraten wirkten. Die Anwendung eines vergleichsweise ineffizienten (sprich langsam reagierenden und niedrig affinen) Substrats wie zum Beispiel des fluoreszenzmarkierten Tripeptids Gly-Gly-Arg-X löste die genannten Probleme auf elegante Weise.
Nachweisverfahren
Licht wird in einer Plasmaprobe von zwei Mechanismen attenuiert: Streuung durch Fibrin, Plättchen und Lipide sowie Absorption durch die Eigenfärbung des Plasmas. Basiert die Bestimmung der Thrombinbildung auf einer Durchlichtmessung, so überlagert die Bildung von Fibrin durch Thrombin das Messsignal. Aufgrund der starken Trübung kann außerdem kein plättchenreiches Plasma eingesetzt werden.
Verwendet man dagegen ein fluoreszenzbasiertes Substrat, so entfallen diese Einschränkungen. Das Fluoreszenzsignal wird durch die Lichtstreuung nicht beeinflusst; die Absorption wirkt sich dann zwar immer noch auf das einfallende und abgestrahlte Licht aus, doch dieser „Inner Filter Effect" kann mithilfe eines Kalibrators korrigiert werden.
Zu beachten ist auch der Einfluss des Thrombininhibitors α2-Makroglobulin auf den Test. Während dieses Protein die Spaltung natürlicher, hochmolekularer Substrate wie Fibrinogen hemmt, beeinflusst es die Spaltung des synthetischen Substrats nicht, sodass die Thrombinaktivität zu hoch gemessen wird. Dieser Anteil muss aus dem Ergebnis herausgerechnet werden; für kommerzielle Assays wird dafür eine Softwarelösung angeboten, die aber gelegentlich zu nicht auswertbaren Messungen führt.
Das neue Hämostasemodell
Mit der Jahrtausendwende änderte sich das Verständnis der Gerinnungsprozesse grundlegend. Das klassische Wasserfall-Modell, bestehend aus intrinsischem und extrinsischem System sowie gemeinsamer Endstrecke, wurde in ein zellbasiertes Modell überführt[3]; wegen der Phospholipidabhängigkeit vieler Gerinnungsprozesse finden die genannten Prozesse nicht wie im Reagenzglas in der wässrigen Phase, sondern nahezu ausschließlich auf der Oberfläche aktivierter Zellen, insbesondere der Blutplättchen, statt.
Das neue Hämostasemodell gliedert sich ebenfalls in drei Phasen, die jedoch anders definiert sind: Die Initiationsphase beschreibt den Weg von der Aktivierung an der Wundoberfläche bis zu den ersten Spuren von Thrombin; sie wird initiiert durch Tissue Factor und FIXa (Josso-Schleife). Es folgt die Amplifikationsphase, in der Thrombin die „Brandbeschleuniger" FV und FVIII aktiviert, sodass die Thrombinbildung durch positive Rückkopplung stark ansteigt. In der dritten, der Propagationsphase, wird über FXI und FIX die maximale Thrombinbildungsgeschwindigkeit (Thrombin Peak) erreicht. In manchen Publikationen folgt noch eine vierte Phase, in der die Thrombinbildung durch Verbrauch und Inhibition wieder abklingt.
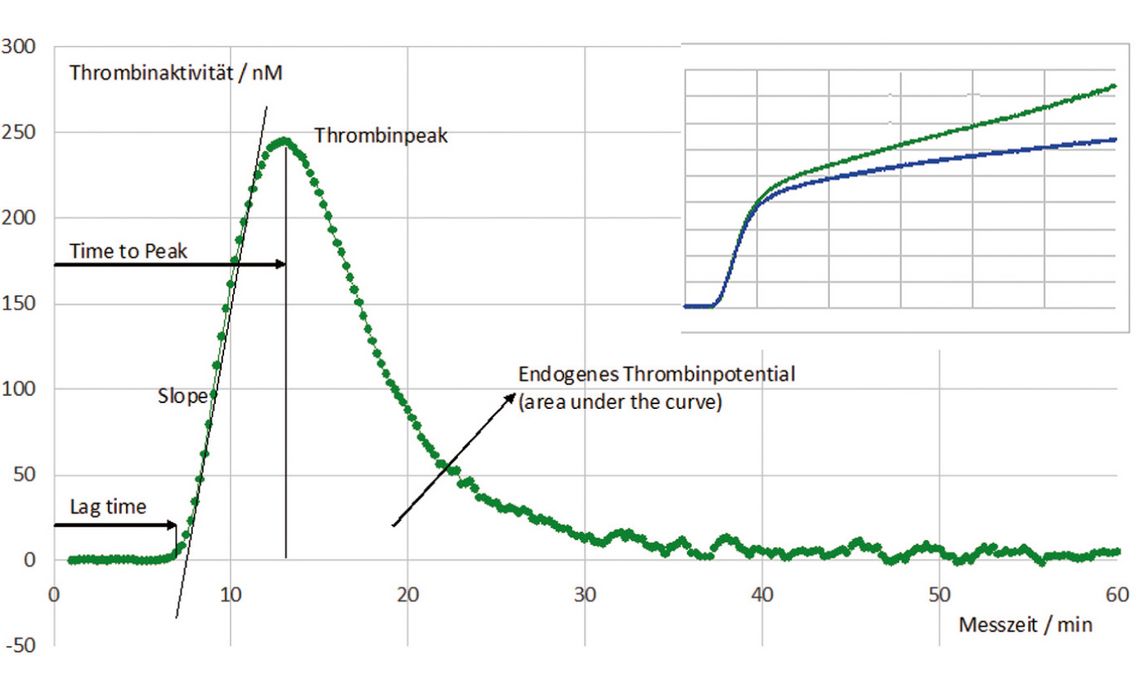
Diese Abläufe spiegeln sich im Thrombinbildungstest nahezu exakt wider (vgl. Abb. 1). Bei der Auswertung erfasst man unterschiedliche Parameter der Messkurve. Die Verzögerungszeit (Lag Time) bis zum Eintritt erster Thrombinspuren entspricht der Initiationsphase und wird durch FVII und insbesondere FVIIa sowie ihre Gegenspieler TFPI und Protein S maßgeblich bestimmt. Zeit und Anstieg bis zum Peak (Time to Peak und Slope) korrelieren insbesondere mit FV, FVIII und FIX. Anschließend wirken sich FVIII, FIX und FXI auf den Thrombinpeak aus. Seine Höhe sowie die Fläche unter der Messkurve (AUC, Endogenes Thrombinpotenzial) korrelieren positiv mit der Prothrombinkonzentration und negativ mit dem Antithrombinspiegel.
Auch Menge und Funktion der Blutplättchen gehen in das Ergebnis ein: Sie beschleunigen die Lag Time und erhöhen die Thrombinbildungsgeschwindigkeit. Die Wirkung von Protein C und insbesondere die Resistenz gegen dessen aktivierte Form (APC) kann erst durch Zugabe von Thrombomodulin oder APC zum Testansatz dargestellt werden.