Weltweit sind bis dato mehr als 66 Millionen Menschen an COVID-19 erkrankt; 1,5 Millionen Menschen hat die Infektionskrankheit bereits das Leben gekostet. Die meisten mit SARS-CoV-2 infizierten Patienten sind entweder asymptomatisch oder weisen nur leichte bis mittelschwere respiratorische Symptome auf. Circa 15 % der Patienten entwickeln jedoch ein schweres Krankheitsbild mit Lungenentzündung und davon etwa 20 % einen kritischen Verlauf mit beatmungspflichtigem Lungenversagen und Multiorgandysfunktion [1].
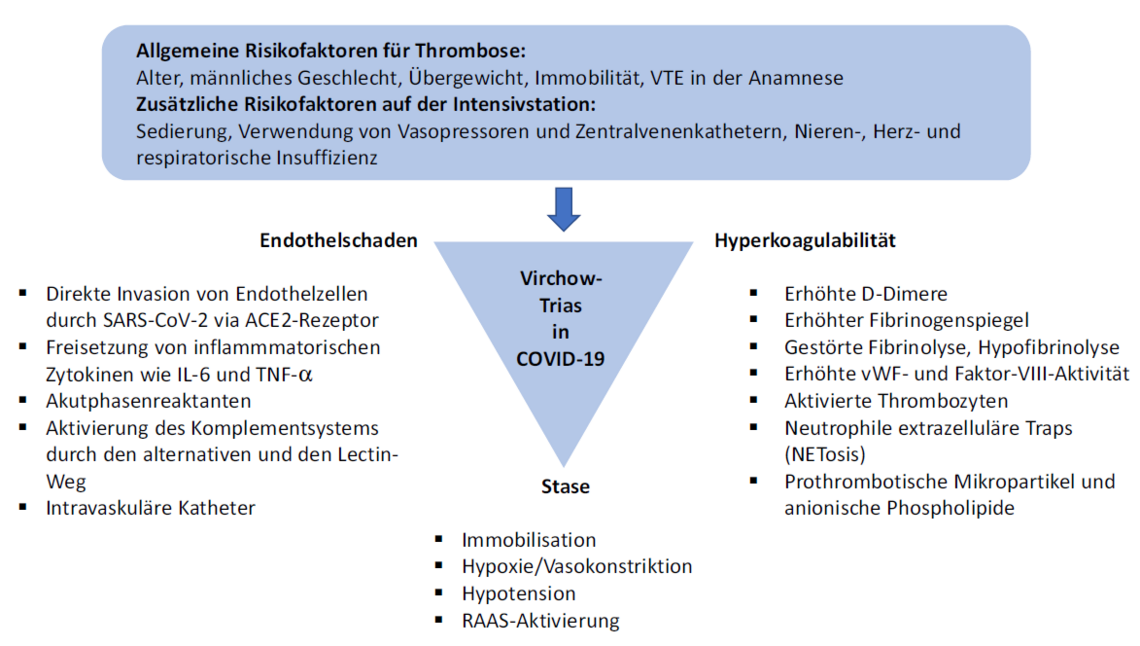
Eine ausgeprägte Koagulopathie scheint eine zentrale Rolle in der SARS-CoV-2-Infektion zu spielen, die sich am häufigsten als prothrombotischer Zustand mit einer erhöhten Inzidenz von venösen und arteriellen Thrombosen manifestiert. Die Pathogenese ist immer noch nicht vollständig geklärt und schließt wahrscheinlich ein komplexes Zusammenspiel zwischen entzündlichen und prothrombotischen Faktoren ein [2], wobei eine hyperinflammatorische Reaktion mit Zytokinsturm, Endothelschäden, Hyperkoagulierbarkeit mit gesteigerter Thrombin- und Thrombozytenaktivierung, NETose und Komplementaktivierung eine wichtige Rolle spielt [3] (Abb. 1).