Im Dezember 2019 wurde in Wuhan, Provinz Hubei, China ein bislang unbekanntes Coronavirus als Auslöser schwerer Lungenentzündungen identifiziert. Es wurde „Severe Acute Respiratory Syndrome-Coronavirus-2“ (SARS-CoV-2) und die dadurch ausgelöste Infektion „COVID-19“ genannt.
Im Vergleich zu den zur gleichen Familie gehörenden (Beta-)Coronaviren SARS (Severe Acute Respiratory Syndrome) und MERS (Middle Eastern Respiratory Syndrome), die zu den Epidemien 2002–2003 bzw. 2012 führten, hat SARS-CoV-2 zwar eine niedrigere Mortalität (2,3 % versus 9,5 % bei SARS und 34,4 % bei MERS), und bei den meisten Patienten eine mildere klinische Symptomatik, jedoch ein wesentlich höheres Reproduktionspotenzial (R0 2–2,5 versus 1,7–1,9 bei SARS und < 1 bei MERS). Weiterhin besitzt es eine 10–20-fach höhere Affinität für ACE2 [1], das als Eintrittspforte in die Zelle dient, als SARS. Dies sind wohl die Ursachen dafür, dass diese Erkrankung sich bereits nach wenigen Monaten zu einer globalen Pandemie mit weltweit bislang knapp 106 Mio. Infizierten und über 2,3 Mio. Todesfällen (Stand 7.2.2021) entwickelt hat.
Obwohl der überwiegende Anteil der Infizierten eine milde klinische Symptomatik zeigt, müssen dennoch 20 % in stationäre Behandlung, davon werden im Verlauf der Erkrankung etwa 20 % intensivpflichtig. Die Mortalität dieser Patienten wiederum beträgt dann erschreckende 50–80 %[2]. Niemals in der neueren Geschichte sah sich unser Gesundheitssystem einer größeren Herausforderung gegenüber, und obwohl man in der Zwischenzeit viel über das neue Virus weiß, sterben weiterhin zahlreiche Menschen daran.
Histopathologische Untersuchungen im Rahmen von Obduktionen an COVID-19 Verstorbener oder Organ-Biopsien Erkrankter zeigen, dass es sich hier bei Weitem nicht nur um eine Erkrankung des respiratorischen Systems, sondern um eine komplexe Systemerkrankung handelt, die auch zahlreiche andere Organe in unterschiedlichem Schweregrad betrifft. Außerdem zeigt die Erkrankung COVID-19 einige Besonderheiten, die sie von anderen Virusinfektionen unterscheidet.
Respiratorisches System
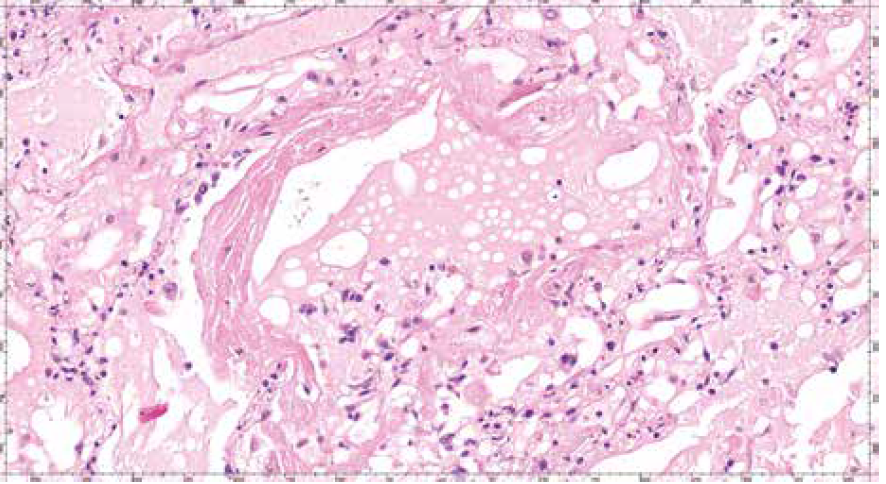
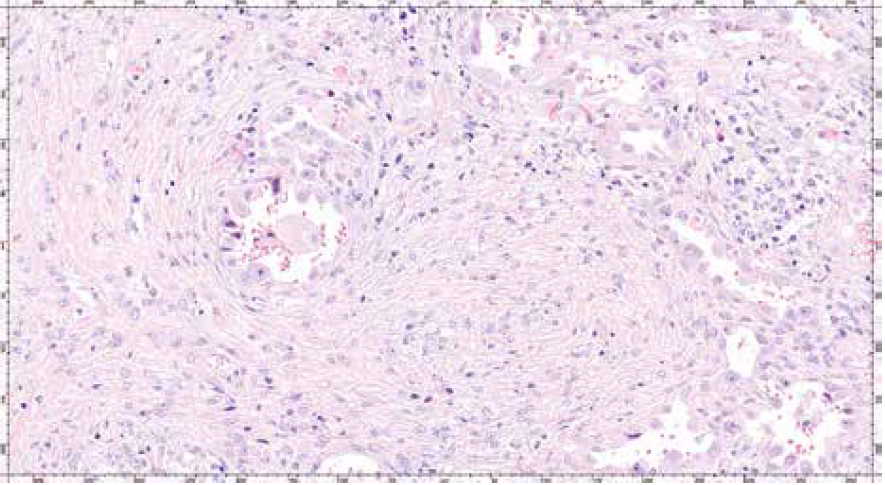
Studienübergreifend zeigten die Lungen aller Patienten das Bild eines diffusen alveolären Lungenschadens (DAD) mit hyalinen Membranen, teils frisch, teils bereits im organisierten Stadium (vgl. Abb. 1 und 2). Auffällig war weiterhin eine Hyperplasie von Pneumozyten vom Typ 2, z. T. mit virustypischen zytopathischen Veränderungen und Bildung multinukleärer Riesenzellen, sowie fokal auch eine Plattenepithelmetaplasie in den Alveolarräumen. In einem Teil der Fälle wurde auch ein chronisches interstitielles Entzündungsinfiltrat gesehen [2–5]. Ein identisches Entzündungsbild wurde auch bei SARS 2002–03 beschrieben.
Interessant ist allerdings die Beobachtung, dass bei Patienten, die bereits kurz nach stationärer Aufnahme an COVID-19 verstarben, nicht selten ein diffuser alveolärer Lungenschaden gesehen wurde, der sich schon im Organisationsstadium befand. Dies wurde bei SARS erst nach einer Hospitalisierungsphase von mindestens 10 Tagen diagnostiziert.
Diese Beobachtung wirft die Frage auf, ob die Lungenschädigung bei COVID-19 möglicherweise bereits im asymptomatischen Stadium im Sinne einer direkten Virus-Zytotoxizität beginnt und der später auftretende DAD Ausdruck einer überschießenden Immunreaktion sein könnte [4].
Im Vergleich mit Lungen von an Influenza A (H1N1) Verstorbenen konnte eine weitere Studie zeigen, dass die Lungen von an COVID-19 Verstorbenen elektronenmikroskopisch schwere Endothelschäden und eine signifikant vermehrte pathologische Angiogenese aufwiesen [6].
Häufig wurde auch eine schwere Tracheobronchitis mit aphtösen Ulcera gesehen, die nicht im Zusammenhang mit künstlicher Beatmung oder einer bakteriellen Superinfektion stand und somit wohl als direkt Virus-assoziiert zu werten ist. Der immunhistochemische Nachweis von Spike-Protein als auch der Nachweis von RNA des SARS-CoV-2 nicht nur in der Lunge, sondern auch in den Zellen des respiratorischen Epithels von Trachea und Bronchien stützt diese These [2–4]. Der elektronenmikroskopische Nachweis von Viruspartikeln in diesen Zellen wird in der Literatur kontrovers diskutiert.