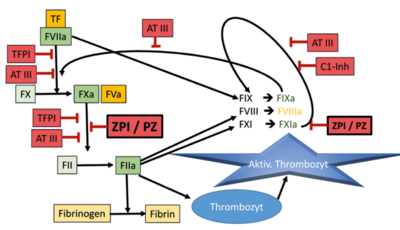
Die Regulation der Hämostase erfolgt über ein komplexes Zusammenspiel von Thrombozyten, anderen Blutzellen, Gefäßwandendothel und verschiedenen adhäsiven, prokoagulatorischen, inhibierenden und Gerinnsel-auflösenden Plasmaproteinen. Ein bisher weniger bekanntes regulatorisches Protein der Gerinnungskaskade ist das 62 kDa große Glykoprotein Protein Z (PZ) [1]. Es wird in der Leber gebildet und durch einen Vitamin-K-abhängigen Schritt durch Ausbildung von γ-Carboxygruppen chemisch so modifiziert, dass es über Kalziumionen an negativ geladene Phospholipide wie z. B. Phosphatidylserin an der Oberfläche von aktivierten Thrombozyten binden kann. Die Halbwertszeit von Protein Z beträgt 2 bis 3 Tage [2]. In Ermangelung von funktionellen Tests erfolgt die Messung von Protein Z in Plasma in der Regel mit einem Enzymimmunoassay (ELISA). Die Konzentration liegt etwa je nach Methode bei ca. 1–3 µg/ml. Einige Studien finden etwas höhere Werte bei Männern. Vitamin-K-Antagonisten oder ausgeprägte Leberfunktionsstörungen führen zu einer starken Verminderung von Protein Z, mehr noch als bei anderen Vitamin-K-abhängigen und strukturähnlichen Gerinnungsfaktoren und Antikoagulanzien wie Protein S oder Protein C [3, 4].
PZ-Funktionen in der Hämostase
Anders als die ebenfalls durch Vitamin K modifizierten und strukturähnlichen Gerinnungsfaktoren II, VII, IX, X oder Protein C zeigt Protein Z keine enzymatische Aktivität. Protein Z ist wohl in erster Linie ein essenzieller Cofaktor für einen wichtigen Proteaseinhibitor der Gerinnungskaskade, dem sogenannten Protein-Z-abhängigen Protease-Inhibitor (ZPI). In Plasma liegt PZ an ZPI gebunden als 1 : 1-Komplex vor. ZPI – ein 72 KDa schweres Glykoprotein aus der Serpinfamilie – bildet zusammen mit PZ, Kalziumionen und Phospholipiden an der Zelloberfläche einen Komplex, der den für die Gerinnselentstehung notwendigen Gerinnungsfaktor Xa (FXa) inaktiviert [5]. Protein Z hat dabei die Funktion, ZPI an die Oberfläche zu binden.
ZPI allein ist kinetisch ineffektiv, während Protein Z die Hemmung von FXa durch ZPI an der Phospholipidoberfläche etwa 1.000-fach beschleunigt und so für eine sehr rasche Inaktivierung von FXa sorgt [6]. Wie auch bei anderen Serpinen wie Antithrombin stimuliert Heparin die Aktivität von ZPI [7]. Die Hemmung der Blutgerinnung auf der Stufe von FXa durch ZPI/Protein Z reduziert erheblich die Bildung von Thrombin, ähnlich wie durch Tissue Factor Pathway Inhibitor (TFPI), dem wichtigsten Inhibitor von Faktor Xa neben Antithrombin (ATIII) [8].
Der Komplex aus ZPI/PZ kann auch andere aktivierte Gerinnungsfaktoren schwach hemmen. Außer für die direkte Hemmung von FXIa durch ZPI/Protein Z, auch in Abwesenheit von Heparin, ist das aber physiologisch vermutlich nicht von Bedeutung [9]. Das Endprodukt der Gerinnungskaskade, Thrombin, wird in Anwesenheit von Protein Z an Zelloberflächen von z. B. aktivierten Thrombozyten gebunden, was ein Wegdiffundieren und damit eine schnelle Inaktivierung von Thrombin im Plasma durch dessen wichtigste Inhibitoren Antithrombin (AT III), Heparin-Cofaktor II oder α2-Makroglobulin erschwert. Möglicherweise hat Protein Z über diesen Mechanismus auch eine prokoagulatorische Wirkung [10].
Dass Protein Z bzw. ZPI eine wichtige Bedeutung in der Hämostase haben, zeigt auch eine aktuelle Studie in einem Mausmodell, wo bei genetisch erzeugtem Mangel an FVIII durch Hemmung von Protein Z bzw. ZPI die Thrombinbildung und damit die Blutstillung massiv verbessert wurde. Dies ist auch ein potenzieller Ansatz für die Therapie der Hämophilie über eine Inaktivierung von Protein Z bzw. ZPI [11].
Z-Funktionen in der Hämostase
Anders als die ebenfalls durch Vitamin K modifizierten und strukturähnlichen Gerinnungsfaktoren II, VII, IX, X oder Protein C zeigt Protein Z keine enzymatische Aktivität. Protein Z ist wohl in erster Linie ein essenzieller Cofaktor für einen wichtigen Proteaseinhibitor der Gerinnungskaskade, dem sogenannten Protein-Z-abhängigen Protease-Inhibitor (ZPI). In Plasma liegt PZ an ZPI gebunden als 1 : 1-Komplex vor. ZPI – ein 72 KDa schweres Glykoprotein aus der Serpinfamilie – bildet zusammen mit PZ, Kalziumionen und Phospholipiden an der Zelloberfläche einen Komplex, der den für die Gerinnselentstehung notwendigen Gerinnungsfaktor Xa (FXa) inaktiviert [5]. Protein Z hat dabei die Funktion, ZPI an die Oberfläche zu binden.
ZPI allein ist kinetisch ineffektiv, während Protein Z die Hemmung von FXa durch ZPI an der Phospholipidoberfläche etwa 1.000-fach beschleunigt und so für eine sehr rasche Inaktivierung von FXa sorgt [6]. Wie auch bei anderen Serpinen wie Antithrombin stimuliert Heparin die Aktivität von ZPI [7]. Die Hemmung der Blutgerinnung auf der Stufe von FXa durch ZPI/Protein Z reduziert erheblich die Bildung von Thrombin, ähnlich wie durch Tissue Factor Pathway Inhibitor (TFPI), dem wichtigsten Inhibitor von Faktor Xa neben Antithrombin (ATIII) [8].
Der Komplex aus ZPI/PZ kann auch andere aktivierte Gerinnungsfaktoren schwach hemmen. Außer für die direkte Hemmung von FXIa durch ZPI/Protein Z, auch in Abwesenheit von Heparin, ist das aber physiologisch vermutlich nicht von Bedeutung [9]. Das Endprodukt der Gerinnungskaskade, Thrombin, wird in Anwesenheit von Protein Z an Zelloberflächen von z. B. aktivierten Thrombozyten gebunden, was ein Wegdiffundieren und damit eine schnelle Inaktivierung von Thrombin im Plasma durch dessen wichtigste Inhibitoren Antithrombin (AT III), Heparin-Cofaktor II oder α2-Makroglobulin erschwert. Möglicherweise hat Protein Z über diesen Mechanismus auch eine prokoagulatorische Wirkung [10].
Dass Protein Z bzw. ZPI eine wichtige Bedeutung in der Hämostase haben, zeigt auch eine aktuelle Studie in einem Mausmodell, wo bei genetisch erzeugtem Mangel an FVIII durch Hemmung von Protein Z bzw. ZPI die Thrombinbildung und damit die Blutstillung massiv verbessert wurde. Dies ist auch ein potenzieller Ansatz für die Therapie der Hämophilie über eine Inaktivierung von Protein Z bzw. ZPI [11].
PZ-Mangel und Blutungen
Bei Protein-Z-Mangel wurde eine Blutungsneigung beschrieben, insbesondere der Schleimhaut, postoperativ sowie Hämatome [12]. Eine andere Studie fand, dass bei Männern niedrige Spiegel von Protein Z mit Blutungen assoziiert waren [3]. Eine Fallbeschreibung berichtet über intraoperative Blutungsprobleme bei einem jugendlichen Patienten mit Protein-Z-Mangel, die bei einem chirurgischen Eingriff den Einsatz eines Prothrombinkomplex-Präparates (kann je nach Präparat auch Protein Z enthalten) erforderte [13]. Nach neueren Resultaten einer deutschen Arbeitsgruppe findet man bei präoperativ niedrigen Spiegeln von Protein Z verstärkt intraoperative Blutungen [14]. Hier sind weitere Studien unbedingt wünschenswert, da die Prädiktivität für Blutungen bei konventionellen Gerinnungstests durch deren wenig physiologische Prinzipien ja eher mäßig ist.