Vier Nervensysteme steuern das Immunsystem bei Rheuma: 1) Das sensible Nervensystem macht neurogene Entzündung (hat aber auch antientzündliche Funktionen), 2) das sympathische Nervensystem ist pro- und antientzündlich, 3) das parasympathische Nervensystem ist vorrangig antientzündlich und 4) das enterische Nervensystem bedarf weiterer Klärung. Die Nervensysteme besitzen spezifische Nervenbahnen mit Neurotransmittern/Neuropeptiden. Die Heterogenität der Wirkungen auf das Immunsystem erklärt sich durch eine Vielzahl an Rezeptoren mit teils gegensätzlich wirkenden Signalkaskaden. Die Hemiparese schützt vor rheumatischen Entzündungssituationen, was für die bedeutende Rolle dieser Nervensysteme spricht. Erste Therapien auf dem Boden der Nervensysteme kommen in die Klinik (Electroceuticals).
Schlüsselwörter: Nervenbahnen, Neurotransmitter, rheumatoide Arthritis, Rheumatologie
Einleitung
Die neuroendokrine Immunologie interessiert sich für die Einflussnahme des Hormonsystems einerseits und der Nervensysteme mit Nervenbahnen und Neurotransmittern/Neuropeptiden andererseits auf die Entzündung und Immunfunktion, zum Beispiel bei rheumatologischen Krankheiten. Im Gegensatz dazu fokussiert die Neuroimmunologie auf den pathologischen Einfluss des Immunsystems auf neuronale Strukturen (wie bei multipler Sklerose). Wurden vor zwei Jahrzehnten beide Felder oft getrennt behandelt, beginnen sich die Grenzen mehr und mehr aufzulösen. Die neuroendokrine Immunologie hatte in Deutschland ihren Start in den frühen 1990er-Jahren (Förderung durch die Volkswagen-Stiftung und dann durch die DFG). Sie ist seit Ende der 1990er-Jahre im German-Endocrine-Brain-Immune-Network (GEBIN: www.gebin.org) neben anderen Inhalten repräsentiert.
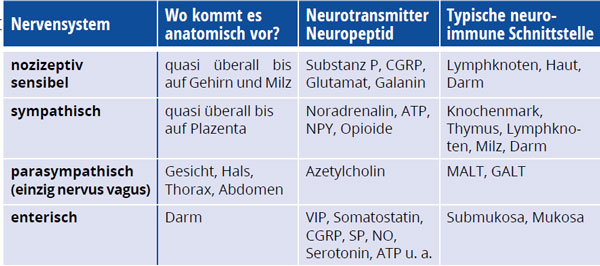
In diesem Artikel wird nun der Einfluss der Nervensysteme auf das Immun-/Entzündungsgeschehen kurz dargestellt (nicht jener der Hormone). Man unterscheidet grundsätzlich vier wichtige Nervensysteme und dementsprechend typische Neurotransmitter/Neuropeptide (Tab. 1). Der Einfluss des enterischen Nervensystems ist bei rheumatologischen Krankheiten bisher nicht untersucht worden. Die Darstellung in diesem Text richtet sich nach chronologischen Kriterien.
Neurogene Entzündung – das sensible Nervensystem (vor 1950–1985)
Die ersten Einflüsse eines Nervensystems auf ein Entzündungsphänomen wurden mit „neurogener Entzündung“ beschrieben [1, 2], die für Kardinalsymptome der Entzündung zuständig sind (Rötung, Wärme, Schwellung/Extravasation, Schmerz, Funktionseinschränkung). Dabei meint man im Wesentlichen den Einfluss des nozizeptiven, sensiblen Nervensystems mit den wichtigen Neuropeptiden Substanz P und Calcitonin-Gen-reguliertes-Peptid (CGRP) (Tab. 1). Bei Aktivierung dieser Nervenbahnen unterscheidet man die afferente Funktion der Schmerzübermittlung zum Rückenmark und Gehirn von der efferenten Funktion der peripheren Neuropeptid-Ausscheidung rund um das Endköpfchen der peripheren Nervenzelle.
Die Anwesenheit von Substanz P und CGRP induziert Vasodilatation und Plasmaextravasation mit Rötung, Schwellung und Überwärmung. Substanz P stimuliert darüber hinaus sehr viele immunologische und entzündliche Vorgänge, zum Beispiel die Chemotaxis von Immunzellen. CRGP kann hinsichtlich immunologischer Vorgänge oft entzündliche Pfade hemmen. Das Verhältnis der beiden Neuropeptide zueinander dürfte daher für die jeweilige Richtung des Einflusses sehr relevant sein.
Die neurogene Entzündung ist ein Sofortphänomen im Bereich von Sekunden, Minuten bis Stunden (ist aber auch immer relevant bei chronischer Entzündung). Es dient der sofortigen Aktivierung des Immunsystems in der schmerzhaften Region und führt zur Akkumulation von zirkulierenden Immunzellen am Ort des Geschehens (Vasodilatation, Adhäsion, Chemotaxis).
Capsaicin – ein Antagonist am TRPV1 auf der Nervenendigung – war lange Zeit der typische Faktor zur Auslösung dieser Substanz-P-vermittelten Reaktion. Die Nervenendigung der nozizeptiven Faser ist eine multimodale Empfangsantenne für vielfältige Entzündungsfaktoren. Bei Arthritis kann die nozizeptive Nervenfaser durch Zytokine wie TNF, IL-1β, IL-6 und IL-17A stimuliert werden [3].
Nicht immer muss die Stimulation des sensiblen Nervensystems eine proinflammatorische Bedeutung haben, wenn zum Beispiel der antiinflammatorische Neurotransmitter CRGP gegenüber Substanz P überwiegt. So konnte gezeigt werden, dass die durch Streptococcus pyogenes ausgelöste Aktivierung sensibler Nervenfasern zu einer entzündungshemmenden Freisetzung des CGRP führt, wodurch die Immunfunktion gegenüber diesem Erreger stark eingeschränkt wird (das fördert dann die nekrotisierende Fasziitis). Die Antagonisierung von CGRP war in diesen Experimenten günstig, da auf diese Weise die Bakterien eliminiert werden konnten [4]. Insofern spielen Substanz P und CGRP, und somit das sensible Nervensystem, eine duale Rolle gegenüber dem Immunsystem, wobei die proinflammatorische Rolle des Substanz P überwiegen dürfte.
Das bekannte Phänomen der Entzündungshemmung durch eine halbseitige Lähmung (Hemiplegie), die bei rheumatoider Arthritis (RA), Gichtarthritis, Psoriasisarthritis, RA-Vaskulitis, Sklerodermie u. a. beobachtet wurde, dürfte zu einem guten Teil durch die Hemiplegie-bedingte Hemmung des Einflusses des sensiblen Nervensystems zustande kommen [5], könnte aber auch über andere Pfade vermittelt sein [6].