Seit Jahren wurde das Immunsystem in zwei Arme geteilt: angeboren und adaptiv. Der Unterschied liegt in der Spezifität und Geschwindigkeit, mit der die Komponenten der zwei Arme auf Infektionen reagieren. In jüngerer Zeit wurde nun eine Familie von Immunzellen entdeckt, die diese beiden Arme verbindet. Diese Zellen werden als lymphoide Zellen des angeborenen Immunsystems (innate lymphoid cells, „ILCs“) bezeichnet. Ähnlich den Zellen des angeborenen Immunsystems reagieren diese Zellen schnell auf Infektionen und exprimieren keine Antigenrezeptoren. Allerdings sezernieren sie eine Reihe von Entzündungsmediatoren, welche auch von T-Zellen des adaptiven Immunsystems ausgeschüttet werden. Ein besseres Verständnis der Prozesse, die diese Zellen regulieren, kann ihre therapeutische Manipulation ermöglichen. In unserer Studie konnten wir zeigen, dass IL-4/13+-produzierende ILCs der Gruppe 2 (ILC2s) in der frühen Phase der entzündlichen Arthritis sowohl im peripheren Blut als auch im Gelenk vermehrt auftreten und eine regulatorische Funktion haben. Dies deutet darauf hin, dass die gezielte Vermehrung von ILC2s eine Möglichkeit sein könnte, die Entwicklung dieser Krankheit zu beeinflussen.
Schlüsselwörter: Innate lymphoid cells, entzündliche Arthritis
Die Entdeckung und Beschreibung lymphoider Zellen des angeborenen Immunsystems (innate lymphoid cells, „ILCs“) während der letzten zehn Jahre hat unser Verständnis der Immunregulation verändert und dazu beigetragen zu verstehen, wie das Immunsystem die Aufrechterhaltung der Gewebehomöostase beeinflusst. ILCs verbinden die zwei „Arme“ des Immunsystems, die angeborene mit der erworbenen Immunität. Wie die Zellen des angeborenen Immunsystems haben ILCs wichtige Funktionen bei der angeborenen Immunantwort auf infektiöse Mikroorganismen und bei der Regulation von Homöostase und Entzündung; zusätzlich spiegeln sie viele der Phänotypen und Funktionen der T-Zellen wider. Auffallende Ähnlichkeiten zwischen ILC-Untergruppen und T-Zell-Untergruppen in der Expression von Transkriptionsfaktoren, die ihre Differenzierung steuern, und den von ihnen produzierten Zytokinen legen nahe, dass ILCs die angeborenen Gegenstücke von T-Zellen sind. NK-Zellen können als innate Entsprechung der zytotoxischen CD8+-T-Zellen angesehen werden, wohingegen ILC1s, ILC2s, und ILC3s den CD4+-T-Helfer-1(Th1)-, Th2- und Th17-Zellen entsprechen. Im Gegensatz zu den T-Zellen exprimieren ILCs allerdings keine antigenspezifischen Rezeptoren und durchlaufen nach Stimulierung keine klonale Selektion und Expansion; sie sind in sekundären lymphoiden Organen selten und existieren hauptsächlich in nicht-lymphoidem Gewebe als „tissue-resident cells“. T-Zellen übertreffen die Anzahl der ILCs in vielen Organen bei Weitem, doch kommt den ILCs, welche vor allem an mukosalen Grenzflächen angereichert sind, häufig eine Rolle als Ersthelfer zu, die kritische Immunreaktionen initiieren, noch bevor die adaptive Immunität einsetzt.
Rolle der ILCs bei Entzündungskrankheiten
Die Rolle von ILCs bei der Entstehung und Prävention von Entzündungskrankheiten ist der Gegenstand aktueller Forschungsarbeiten. ILC1s schützen Mäuse vor einer Infektion mit Toxoplasma gondii [1] und spielen eine Rolle bei pathogener Schleimhautentzündung [2]. ILC3s hingegen scheinen ebenfalls zu Entzündungen, z. B. des Darmes beizutragen [3], können aber gleichzeitig auch die Wundheilung nach Hautverletzungen beeinflussen [4]. ILC2s spielen eine wichtige Rolle bei der Ausstoßung von parasitären Würmern [5] und bei der Typ-2-Immunpathologie nach Allergenexposition in der Lunge [6]. In den Gelenken von Patienten mit Spondylarthritis sind ILC3s angereichert; diese sind eine Quelle der pathogenen Zytokine IL-17 und IL-22 [7–9]. Bei Patienten mit rheumatoider Arthritis (RA) wurden ILC1s und ILC3s in der Synovialflüssigkeit von RA-Patienten nachgewiesen [10, 11], und deren Vorhandensein war positiv korreliert mit der klinischen Krankheitsaktivität [10]. In einer Studie mit Patienten mit präklinischer RA, bei der nicht zwischen ILC1s und ILC2s unterschieden wurde, wurde eine vermehrte Anzahl dieser kombinierten ILC-Population in den Lymphknoten im Vergleich zu gesunden Kontrollen nachgewiesen. Dies deutet darauf hin, dass ILCs an der Entstehung dieser Erkrankung beteiligt sein könnten [12]. Diese Funktionen der ILCs lassen auch auf eine Rolle in der Entwicklung von rheumatoider Arthritis schließen, doch funktionelle Daten dazu sind bisher begrenzt. Kürzlich wurde gezeigt, dass ILC2s die Auflösung von rheumatoider Arthritis über die Sekretion von IL-9 induzieren und durch die Wiederherstellung der suppressiven Kapazität von Tregs eine bereits etablierte chronische Entzündungen dämpfen können [13]. Untersuchungen von ILC2s sind außerdem interessant, weil sie vermutlich mit der Th2-Zellaktivierung in Zusammenhang stehen, welche kürzlich als regulatorischer Signalweg bei RA beschrieben wurde [14].
Rolle der ILCs in der Initiationsphase der RA
In unserer Studie haben wir uns mit der Rolle von ILC2s in der Initiationsphase von RA befasst [15]. Die Zytokinsignatur der ILC2s und die Induktion von Typ-2-Immunantworten führen zu einer verbesserten Gewebereparatur, und damit zu einer Kontrolle von Entzündungen [14, 16]. Darauf basierend stellten wir die Hypothese auf, dass ILC2s eine dämpfende Wirkung auf RA haben. Um diese Hypothese zu testen, untersuchten wir verschiedene ILC2- „Gain-and-loss-of-function“-Modelle in der entzündlichen Arthritis.
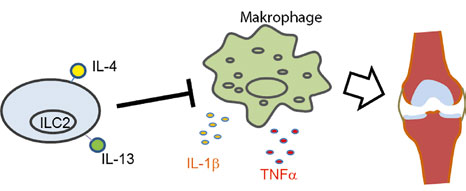
Wir konnten zeigen, dass die ILC2-Zahlen sowohl bei RA-Patienten als auch in Mausmodellen mit entzündlicher Arthritis erhöht sind. Wir beobachteten einen schnellen und frühen Anstieg von IL-4/13+ ILC2s und konnten zeigen, dass sie in der frühen Initiierungsphase der Arthritis eine wichtige Rolle spielen [15]. In zwei Fällen von genetisch reduzierten ILC2-Zahlen wurde die Arthritis verschlimmert, während die therapeutische Verstärkung der ILC2-Zahlen die Arthritis signifikant abschwächte. Diese regulatorische Wirkung von ILC2s war abhängig von ihrer Fähigkeit, IL-4/13 zu sekretieren, da IL4/13-/- ILC2 es versäumten, Arthritis nach Zelltransfer zu dämpfen. IL-4/13 von ILC2 unterdrückten die IL-1β-Produktion durch Makrophagen signifikant. IL-1β ist ein Schlüsselfaktor für frühe klinische Symptome bei serum-induzierter Arthritis (SIA) und RA [17, 18]. Dieser Mechanismus war nur während der Initiierungsphase von Arthritis kritisch, da ein ILC2-Transfer zu späteren Zeitpunkten keine Arthritis dämpfte. Unsere Daten zeigen somit essenzielle regulatorische Funktionen von ILC2 in der entzündlichen Arthritis. Die Erhöhung der ILC2-Zahlen könnte daher eine Methode sein, um die Entwicklung dieser schweren entzündlichen Gelenkerkrankung im frühen Stadium wirksam zu beeinflussen.