Der Mensch lebt im Gleichgewicht mit ungefähr 100 Billionen Mikroorganismen, der sogenannten Mikrobiota. Antikörper spielen eine wesentliche Rolle dabei, dieses Gleichgewicht – die Immunhomöostase – aufrechtzuerhalten. Gleichzeitig schützen sie den Körper vor eindringenden Pathogenen. Mit welchen Mechanismen das humorale Immunsystem die große mikrobielle Vielfalt reguliert, ist bisher wenig verstanden. Am Beispiel von Antikörpern gegen Klebsiella pneumoniae diskutieren wir hier die Möglichkeit der spezifischen Regulation der intestinalen Mikrobiota durch kreuzspezifische Antikörper und ihren potenziellen klinischen Nutzen gegen bakterielle Infektionen.
Schlüsselwörter: Antikörper, Immunoglobulin A, Mikrobiota, Klebsiella pneumoniae, O-Antigen
Die Diversität der Mikrobiota
Der menschliche Gastrointestinaltrakt ist mit ca. 500–1.000 mikrobiellen Spezies besiedelt und erreicht die größte Dichte an Mikroorganismen im menschlichen Körper [1]. Jede dieser Spezies besitzt eine Vielzahl an Strukturen an der Oberfläche, sogenannte Antigene, die von Antikörpern erkannt werden können. Dabei können Antikörper selbst feinste Unterschiede in der molekularen Zusammensetzung dieser Antigene erkennen. Historisch wurde diese Fähigkeit des humoralen Immunsystems genutzt, um Bakteriensubtypen mithilfe von Antiseren zu klassifizieren. In den letzten Jahren haben Genomsequenzierungen und Strukturanalysen gezeigt, dass die tatsächliche Antigenvielfalt größer ist als die Zahl der bisher beschriebenen Serotypen [2]. Dies legt die Frage nahe, wie das humorale Immunsystem die Homöostase mit der großen Anzahl unterschiedlicher Mikroben im Darm aufrechterhält und dabei trotzdem in der Lage ist, den Körper effizient vor eindringenden Pathogenen zu schützen.
Die intestinale humorale Immunantwort
Antikörper besitzen vielfache Funktionen in der Regulation der Mikrobiota, z. B. die Neutralisation von Toxinen, die Verhinderung des Eindringens von Bakterien in den Organismus oder die Regulation der bakteriellen Replikation durch Verklumpung [3–5]. Spezifische Antikörperantworten im Darm werden präferenziell, aber nicht ausschließlich gegen enteropathogene Bakterien gebildet [6–9]. Sie bestehen hauptsächlich aus Immunoglobulin (Ig) vom Typ A (IgA) und werden zumeist in speziellen sekundären lymphoiden Strukturen generiert, den sogenannten Peyerschen Plaques. B-Zellen, die sich nach ihrer Aktivierung im Darm zu Plasmazellen entwickeln und unterhalb des Darmepithels ansiedeln, sind die Produzenten löslicher Antikörper. Mithilfe des polymeric-Ig-Rezeptors werden die Antikörpermoleküle über die Epithelschicht in das Darmlumen transportiert.
Antikörperantworten im Darm können T-Zell-abhängig oder T-Zell-unabhängig gebildet werden [9, 10]. T-Zell-unabhängige Antikörperantworten sind zumeist gegen Nicht-Protein-Antigene gerichtet. Aufgrund der fehlenden T-Zell-Hilfe durchlaufen die Zellen keine Affinitätsreifung. Charakterisiert sind die Antworten daher durch die Sezernierung wenig spezifischer Antikörper mit eher niedriger Affinität. Diese unspezifischen Antikörper sind schon Teil des naiven Antikörperrepertoires und werden deswegen auch häufig als natürliche Antikörper definiert. In Mäusen wurde gezeigt, dass natürliche Antikörper im Darm häufig polyreaktiv sind [10, 11]. Polyreaktive Antikörper besitzen eine hohe Flexibilität in ihrer Antigenbindung [12]. Sie können so strukturell unterschiedliche Zielstrukturen erkennen und übernehmen eine unspezifische Funktion in der Immunhomöostase. Allerdings bieten sie keinen spezifischen Schutz vor eindringenden Pathogenen und sind therapeutisch nicht nutzbar.
Im Gegensatz dazu erkennen Antikörper, die in T-Zell-abhängigen Antworten entstanden sind, ihr Zielantigen mit hoher Affinität und Spezifität. Diese Eigenschaften beruhen auf dem Vorkommen von Mutationen in den Immunoglobulingenen, die die Affinität und Spezifität des Antikörpers erhöhen und im Laufe der B-Zellantwort mithilfe von T-Zellen selektioniert wurden. Im menschlichen Darm reichern sich B-Zellen, die mutierte Antikörper bilden, nach der Geburt stark an, bis sich die mittlere Anzahl der Mutationen pro Antikörper auf einem Mittelwert einpendelt [14]. Im Erwachsenenalter besteht das intestinale Antikörperrepertoire so gut wie nur noch aus mutierten Antikörpern. Das intestinale Antikörperrepertoire ist zudem oligoklonal, d. h. es zeigt eine niedrige Diversität durch die klonale Expansion einzelner B-Zellen [13, 15]. Zusammen lassen diese Beobachtungen vermuten, dass der Großteil der B-Zellen im Darm von Erwachsenen Antikörper bildet, die in Abhängigkeit von T-Zellen entstanden sind und als Folge der Affinitätsreifung ihre Zielantigene spezifisch und hochaffin binden [13]. Der menschliche Darm ist daher ein Reservoir für die Gewinnung von Antikörpern gegen eine Vielzahl von Mikroben, die aufgrund ihrer spezifischen Bindeeigenschaften ideal für die klinische Anwendung geeignet sind und zum Beispiel vor bakteriellen Infektionskrankheiten schützen könnten, wie wir in unseren Arbeiten zu Klebsiella pneumoniae (K. pneumoniae) beispielhaft zeigen konnten.
Kreuzspezifische Antikörper gegen K. pneumoniae O-Antigen
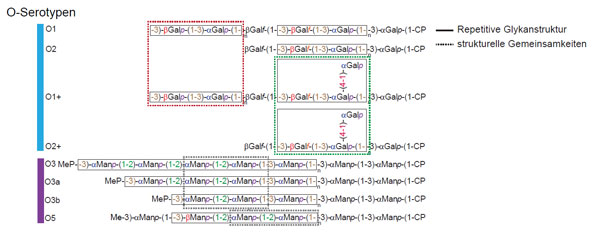
Klinisch erprobte monoklonale Antikörper gegen bakterielle Infektionen sind kaum vorhanden, obwohl sie als eine der vielversprechendsten Alternativen zur Behandlung von Infektionen mit antibiotikaresistenten Bakterien gehandelt werden. Einer der Gründe dafür ist die Vielfalt der Serotypen innerhalb einer Spezies. Therapeutische Antikörper sollten idealerweise gegen alle Serotypen gerichtet sein. K. pneumoniae ist ein opportunistisches Pathogen, das zumeist Patienten mit geschwächtem Immunsystem, z. B. Neugeborene oder immunkomprimierte Patienten, infiziert. Diese Spezies besitzt nur eine limitierte Anzahl an O-Serotypen, die zusätzlich strukturelle Gemeinsamkeiten untereinander aufweisen. Mehr als 80% der klinischen Isolate von K. pneumoniae gehören zu einem von acht O-Serotypen. Diese unterscheiden sich in der Struktur ihres Lipopolysaccharid (LPS)-Moleküls, genauer gesagt ihrem O-Antigen, der repetitiven Glykanstruktur des LPS (Abb. 1). Aufgrund der relativ limitierten Diversität ist das O-Antigen ein ideales Ziel für die Entwicklung therapeutischer Antikörper. Das Ziel unserer Arbeit war es, K. pneumoniae O-Antigen-bindende und möglicherweise kreuzspezifische Antikörper mit Wirksamkeit gegen verschiedene O-Serotypen im Menschen zu identifizieren und funktional zu charakterisieren. Mithilfe von fluoreszenz-markiertem O-Antigen konnten wir einzelne O-Antigen-spezifische Plasmazellen aus der Darmwand und ihre klonal verwandten B-Zellen aus dem Blut von erwachsenen Spendern isolieren. Wir beschränkten uns dabei auf die zwei klinisch-relevanten O-Serotypen O1 und O3, die ca. 45% der klinischen K. pneumoniae-Isolate ausmachen und keinerlei Gemeinsamkeiten in ihrer molekularen Zusammensetzung aufweisen. Anschließend amplifizierten, sequenzierten und klonierten wir die Immunglobuline dieser Zellen und stellten die Antikörper rekombinant her, um ihre Antigenbindung zu testen. Entgegen der Annahme, dass Antikörper, die gegen Zuckerantigene gerichtet sind, wenig mutiert und eher unspezifisch binden sollten, wiesen die isolierten Antikörper eine Vielzahl an Mutationen auf und reagierten spezifisch nur mit dem O1- bzw. O3-O-Antigen. Die Mutationen waren essenziell für die Antigenbindung, was nahelegt, dass diese intestinalen Antikörper tatsächlich affinitätsgereift sind und aus T-Zell-abhängigen Immunantworten hervorgegangen sind. Trotz ihrer Spezifität waren die Antikörper in der Lage, mehrere unterschiedliche Serotypen zu erkennen. Zudem konnten sie im Tiermodell vor der Infektion mit verschiedenen Serotypen schützen. Die Daten zeigen, dass das menschliche Immunsystem Antikörper mit breiter Wirksamkeit gegen verschiedene K. pneumoniae-Serotypen generiert, die von klinischem Nutzen sein könnten.