2018 jährt sich die Vergabe des Nobelpreises an Paul Ehrlich (1908) für die Entwicklung des ersten Modells der Generierung spezifischer Antikörper, Astrid Fagraeus Beschreibung der Plasmazellen als Antikörper-sezernierende Zellen (1948) und Mitchells & Millers Entdeckung, dass Vorläufer der Antikörper-produzierenden Zellen im Knochenmark (engl. Bone marrow) der Maus entstehen (1968). Dieser Übersichtsartikel wird diese drei für die Immunologie wegweisenden Entdeckungen beschreiben.
Schlüsselwörter: Seitenketten-Theorie, Antikörper, Plasmazellen, B-Zelldifferenzierung, Ehrlich
Entdeckung der Antikörper
Antikörper sind Eiweißmoleküle, die von sogenannten Plasmazellen zur Abwehr von pathogenen Keimen in das Gewebe abgegeben werden. Plasmazellen entstehen aus ruhenden B-Lymphozyten (kurz B-Zellen) nach Aktivierung durch z. B. ein Toxin oder Pathogen. Die Erfolgsgeschichte der Antikörper beginnt mit der Beobachtung von Gameleia (1889), Bouchard (1890) und Behring & Nissen (Mai 1890), dass das Blut von Tieren erst nach deren Infektion mit Bakterien eine zerstörende Wirkung auf Bakterien in Kulturen zeigte [1]. Der Siegeszug der Antikörper begann aber erst mit der am 4. Dezember 1890 publizierten und in allen Lehrbüchern als Geburtsstunde der Antikörper und der Serumtherapie gepriesenen Entdeckung von Emil von Behring und Shibasaburo Kitasato. Beide Forscher demonstrierten, dass Tetanus-erkrankte Mäuse durch die Übertragung einer im Serum von Tetanus-immunen Kaninchen vorhandenen löslichen (auch humoral genannt) antitoxischen Aktivität geheilt werden können [2]. Die Erzeugung einer Diphterie-Immunität in Labortieren wurde von Emil von Behring allein am 11. Dezember 1890 [3], und die erfolgreiche Serumtherapie von an Diphtherie erkrankten Meerschweinchen von Emil von Behring zusammen mit Erich Wernicke im Jahre 1892 [4] publiziert (siehe auch Zusammenfassung in Jäck et al. 2017) [5]. Emil von Behring erhielt 1901 allein den ersten Nobelpreis für Physiologie und Medizin für „his work on serum therapy, especially its application against diphtheria“ [6].
Die Seitenketten-Theorie – das erste Modell zur Erklärung der Entstehung spezifischer Antikörper
Paul Ehrlich wurde 1908 der Nobelpreis für Physiologie oder Medizin für seine Verdienste um die Standardisierung der Wertbestimmung in der Serumtherapie und für die theoretische Fundierung der Immunologie verliehen. Ehrlich sah im Gegensatz zu Ilya Metchnikoff, der zusammen mit ihm den geteilten Nobelpreis erhielt, nicht die Phagozyten als Hauptvermittler natürlicher und erworbener Immunität, sondern vertrat den in Deutschland vorherrschenden humoralistischen Ansatz, der zirkulierende Antikörper in das Zentrum der Immunabwehr rückte [7].
Bestärkt durch die Entdeckung der „Alexine“ (später von Ehrlich „Komplement“ genannt) durch Buchner [8] und die Entdeckung der Antikörper durch Behring und Kitasato [2], widmete sich der Mediziner Ehrlich in seinen Studien Ende des 19. Jahrhunderts zunächst der physikochemischen Interaktion von Antikörpern und Toxinen. In seinen Mausexperimenten mit den pflanzlichen Toxinen Ricin [9] und Abrin [10] konnte er die absolute Spezifität der Immunreaktion gegen die einzelnen Toxine belegen, da keine Kreuzprotektivität nach Immunisierung nachweisbar war. Zudem erkannte Ehrlich, dass selbst geringe Toxindosen eine starke Antikörperantwort hervorrufen und transferiertes Immunserum seine protektive Wirkung nach wenigen Wochen verliert. Spezifische Antikörper waren deshalb, wie von Buchner und Metchnikoff angenommen, kein Umwandlungsprodukt des Toxins, sondern wurden aktiv durch Körperzellen nach Immunisierung produziert [11]. Die zelluläre Herkunft der protektiven Antikörper lag allerdings noch völlig im Dunkeln.
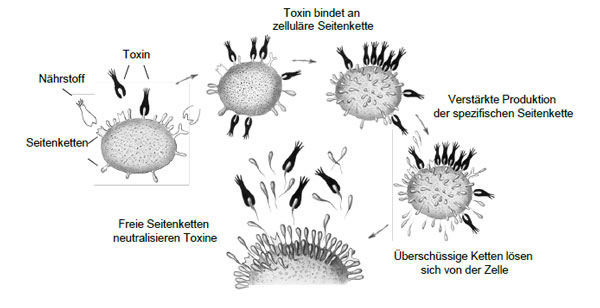
Nach Ehrlichs Vorstellung muss jede wirksame Interaktion von Zellen und Substanzen, wie z. B. Farbstoffe oder Nährstoffe, über einen zellulären Rezeptor erfolgen („Corpora non agunt nisi fixa“) [12]. Aufbauend auf Ergebnissen seiner immunologischen Experimente entwickelte er hieraus das Konzept der Seitenkettentheorie, das für diese Zeitspanne vorherrschende theoretische Fundament, um die Bildung spezifischer Seitenketten bzw. Antitoxine oder Antikörper zu erklären. Bereits 1897 in den Grundzügen dargelegt [11], führte Ehrlich sein Modell zur Entstehung spezifischer Antikörper 1900 in einer Ehrenrede vor der Royal Society in weiterem Detail aus [13].
„Seitenketten“ sind neben dem zentralen „Leistungskern“ (sinngemäß „der Sitz des Lebens“ [14], nicht zu verwechseln mit dem heutigen Zellkern) essenzielle Bestandteile des „Protoplasmas“. In ihrer Funktion als Nutrizeptoren (Nährstoffrezeptoren) binden sie nach Fischers Schlüssel-Schloss-Prinzip spezifische Nährstoffe zur Verstoffwechselung aus dem Blut (Abb. 1). Zufällig binden manche dieser Seitenketten aufgrund struktureller Ähnlichkeiten auch an Toxine, wodurch diese erst ihre schädigende Wirkung auf die Zelle ausüben können. Kann das Toxin aufgrund von Abwesenheit der bindenden Seitenkette nicht mit der Zelle interagieren, tritt keine Giftwirkung auf und das Individuum verfügt über natürliche Immunität. Im Falle einer Bindung blockiert das Toxin jedoch die Nährstoffaufnahme über die spezifische Seitenkette. Die Zelle antwortet auf diesen Mangel mit einer überschießenden Kompensationsreaktion durch eine verstärkte Produktion dieser Seitenkette, getreu dem von Ehrlichs Cousin Carl Weigert beobachteten Prinzip der Hyperplasie nach Gewebeschädigungen [15]. Aufgrund des begrenzten Platzes auf der Zelloberfläche werden die übermäßig produzierten Seitenketten als „nutzloser Ballast“ [13] ins Blut sekretiert, können hier als freie Antikörper Toxine neutralisieren und verhindern so die Toxinbindung an weitere zelluläre Seitenketten. Nach der Seitenkettentheorie kann dem nach jede Zelle, die toxophile Seitenketten produziert, in eine Antikörper-sezernierende Zelle konvertieren. Dabei beschreibt Ehrlich schon gewisse Gewebespezifitäten; so tragen in Meerschweinchen z. B. nur Hirnzellen Seitenketten, die das Tetanustoxin binden können bzw. Tetanus-spezifische Antikörper sekretieren. Wie wir heute wissen, können Neuronen zwar das Tetanustoxin binden, jedoch sind sie nicht in der Lage, Antikörper zu produzieren.