Das Therapierepertoire für die Behandlung rheumatologischer Erkrankungen hat sich insgesamt signifikant gebessert. Festzustellen bleibt, dass nur etwa 70% der Patienten auf die Behandlung ansprechen. Weiterhin ist keine Heilung möglich, sondern in der Regel muss eine lebenslange Therapie mit diesen neuen Medikamenten durchgeführt werden. Ziel zusätzlicher Studien muss es daher sein, über die Pathogenese weitere Informationen zu erhalten, um so gegebenenfalls vorbeugend behandeln zu können bzw. eine Heilung zu erzielen. In jedem Fall wird die Einführung digitaler Mechanismen die Entwicklung individualisierter Therapien für den Patienten verbessern.
Schlüsselwörter: Rheumatoide Arthritis, monoklonale Antikörper, Immunsuppressiva, Biologika
Einleitung
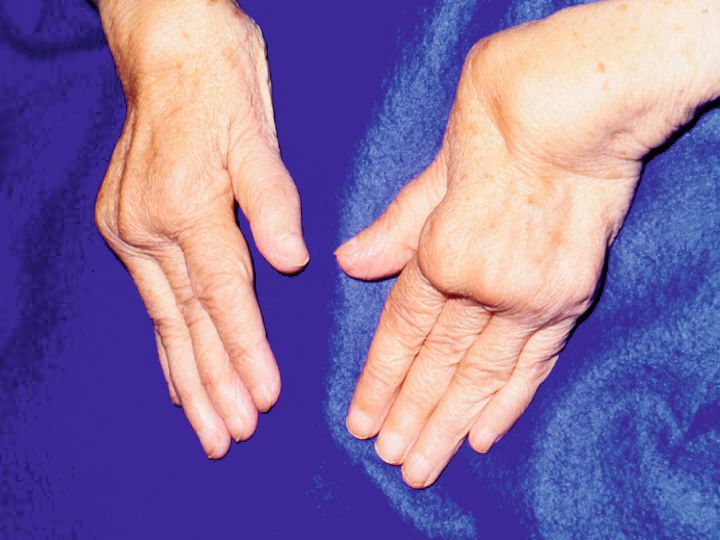
Zu Beginn meiner Zeit als Direktor der Medizinischen Klinik III am Universitätsklinikum Erlangen-Nürnberg war eine typische „Rheumahand“ noch ein sehr häufiges Erscheinungsbild der rheumatoiden Arthritis. Dabei ist die Deformierung der gezeigten Hände auf eine Zerstörung der Gelenke infolge immunologischer Prozesse zurückzuführen. Zusätzlich hatten Patienten mit einer hochaktiven rheumatoiden Arthritis (RA) eine signifikant erhöhte Mortalität. Dieser progressive Krankheitsverlauf einer RA war den nicht genügend effizienten Therapieoptionen für dieses Krankheitsbild geschuldet. Benutzt wurde die berühmte Therapiepyramide, die anzeigte, dass die Aggressivität der Behandlung mit nichtsteroidalen Antiphlogistika bis zu Immunsuppressiva und Zytostatika sich jeweils an der Krankheitsaktivität des Patienten neu orientierte. Dies ist konträr zu der heutigen Philosophie, die besagt, dass eine rheumatoide Arthritis so früh wie möglich und so aggressiv wie nötig zu behandeln ist, um einen langjährigen Verlauf in einer geringen Krankheitsaktivität zu halten bzw. eine Remission zu erzielen. Dieser signifikante Fortschritt in der Therapie der rheumatoiden Arthritis geht auf eine Intensivierung der Erforschung von gewebszerstörenden Pathomechanismen im Gelenk zurück, verbunden mit der Identifizierung von Zellen wie auch von sogenannten Botenstoffen, sog. Interleukinen, die eine proinflammatorische Eigenschaft besitzen und zentral in die Pathogenese der RA involviert sind.
Zusätzlich war die Entwicklung einer Methodik zur Herstellung monoklonaler Antikörper durch Köhler und Milstein (Nobelpreis 1984) notwendig. Damit war die Möglichkeit zu einem gezielten Eingriff in Pathogenesemechanismen gegeben. Wichtig war ebenso, dass für die Beurteilung der Effizienz neuer Therapieprinzipien Diagnosekriterien sowie Kriterien für die Erfassung der Entzündungsaktivität erstellt wurden.
Derzeit stehen drei neue Optionen zur Therapie von rheumatischen Erkrankungen zur Verfügung.
1. Interferenz mit proinflammatorischen Zytokinen
2. Inhibition eines notwendigen zweiten Stimulus von T-Zellen
3. Depletion von B-Zellen
Anzumerken bleibt jedoch, dass die exakten Wirkungsmechanismen dieser neuen Therapiemöglichkeiten nicht vollständig verstanden sind. Eingriffe in immunpathogenetische Mechanismen erfolgen mit monoklonalen Antikörpern, Rezeptorfusionskonstrukten, die einen zweiten notwendigen Stimulus zur T-Zellaktivierung blockieren, „Biosimilars“ und „small molecules“ (z. B. Kinaseinhibitoren).