Pathophysiologie von Ferritin
Ferritin ist ein ubiquitäres Protein mit einem Molekulargewicht von 450 kD, das im Wesentlichen die Hepcidin-induzierte Speicherung von Eisen reguliert. Ferritin wird durch unterschiedliche Gene kodiert und in den Hepatozyten und den Vorstufen der Erythropoese gebildet. Das Molekül besteht aus 24 elliptoid gefalteten Peptidketten, die durch nicht-kovalente Bindungen verknüpft sind. Die 24 Untereinheiten bilden die 10 Angstroem dicke Wand einer Kugel mit einem Innendurchmesser von etwa 80 Angstroem (Apoprotein).
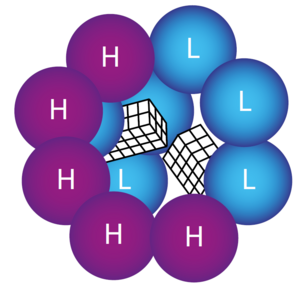
Es werden zwei Formen von Untereinheiten unterschieden: die Heavy(H)-Kette und die Light(L)-Kette (Abb. 1). Die H-Kette hat Ferrioxidase-Aktivität und partizipiert an der Oxidation von Eisen, während die L-Kette die Form der Kugel stabilisiert. Unterschieden werden:
die Eisen- und Hepcidin-abhängige Regulation von intrazellulärem Ferritin. Hepcidin reguliert den Austritt von Eisen aus den Zellen in das Blut durch Bindung an Ferroportin und bewirkt dessen Degradation;
die Regulation der Bildung von Ferritin durch intrazelluläres Eisen.
Regulation der intrazellulären Ferritinsynthese nach Hepcidin-induzierter intrazellulärer Vermehrung von Eisen