Trillium Diagnostik 2018; 16(4): 230-232
In „Microbes and Man“ betonte John Postgate bereits 1969, dass die meisten Bakterien nicht per se pathogen – und deshalb auszurotten – sind, sondern erst, wenn sich die Wechselwirkungen zwischen Mensch und Mikroben zugunsten der Mikroben verschieben und die Bakterien ihr pathogenes Potenzial entwickeln können. Angesichts der Bedrohung durch zunehmende Antibiotikaresistenzen rückt diese Erkenntnis immer stärker in den Fokus der Forschung.
Schlüsselwörter: Antibiotika-Resistenz, Phagentherapie, Pathoblocker, Peptid
In einem Bericht des Weltwirtschaftsforums zu den größten globalen Risiken für die Menschheit rangierten „Antibiotika-resistente Bakterien“ auf den vorderen Rängen [1]. Die Weltbank veranschlagt die dadurch verursachten Zusatzkosten für die Gesundheitssysteme bis zur Mitte dieses Jahrhunderts auf 0,4 bis 1,2 Billionen (!) USD, was sogar über den Kosten der Bankenkrise von 2008 läge [2]. Auch wenn diese Daten auf mit Unsicherheiten behafteten Simulationen und Hochrechnungen basieren [3, 4], machen sie deutlich, dass beim Einsatz von Antibiotika ein generelles Umdenken erforderlich ist, um einer schweren medizinischen und auch wirtschaftlichen Bedrohung unserer Gesellschaft entgegenzuwirken.
Phänomen Antibiotikaresistenz
Resistenzen gegen Antibiotika sind älter als die Menschheit. Kürzlich ließen sich sogar bei Bakterien, die seit ca. 4 Mio. Jahren in unterirdischen Höhlen eingeschlossen waren, weitreichende Antibiotikaresistenzen nachweisen [5]. Im Permafrost Alaskas wurde 30.000 Jahre alte Bakterien-DNA gefunden, die Resistenzgene gegenüber Antibiotika (u. a. Penicillin, Tetracyklin, Vancomycin) aufwies, die erst in den letzten 40 Jahren zur Markteinführung gelangt sind [6]. Diese Beobachtungen zeigen, dass Bakterien konstitutionell in der Lage sind, Resistenz- und Evasionsmechanismen zu entwickeln, die gegen jede Art von biochemischem Target gerichtet sind – in der Vergangenheit, Gegenwart und Zukunft.
Bakterielle Resistenzen spielten in der jüngeren Vergangenheit bei der Therapie keine große Rolle, da genügend Ausweichpräparate zur Verfügung standen. Retrospektiv wird jedoch klar, dass bislang kein Antibiotikum auf den Markt kam, gegen das nicht innerhalb von spätestens zehn Jahren Resistenzen nachgewiesen wurden [7]. Bei manchen Präparaten wie etwa Penicillin waren diese sogar vor der Markteinführung bekannt, bei anderen unmittelbar zur Markteinführung Levofloxacin, Ceftarolin) oder kurz danach (Daptomycin, Ceftazidim).
Vielfältige Strategien
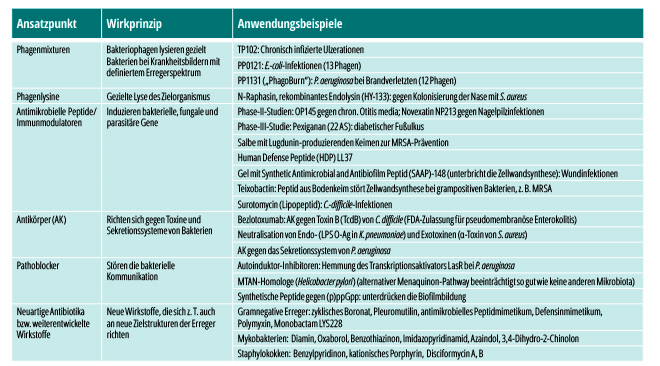
Zukunftsträchtige Strategien zur Infektionsbekämpfung sollten sich aufgrund der bisherigen Erfahrungen mit der klassischen Antiinfektivatherapie breiter aufstellen und könnten in mehrere Kategorien unterteilt werden [8]. An erster Stelle steht dabei natürlich die Primärprävention von Infektionskrankheiten, gefolgt von Strategien, die die weitere Verbreitung von Resistenzen stoppen und dadurch den wirksamen Einsatz von Antibiotika über einen längeren Zeitraum gewährleisten. Weitere Ansatzpunkte sind neue Wege, um Infektionserreger zu attackieren sowie eine Modifikation der Interaktion zwischen Wirt und Erreger bzw. der Erreger untereinander. In Tab. 1 sind die im Folgenden besprochenen Strategien – ohne Anspruch auf Vollständigkeit – zusammengefasst.
Phagen und Phagolysine
Der Einsatz von Bakteriophagen als Therapeutika ist nicht neu, ihre Zulassung als Medikament unter westlichen Standards aber kompliziert. Darüber hinaus ist ihre Entwicklung ein gewisses Wagnis, da möglicherweise die Patientenakzeptanz fehlt. Phagen sind hochspezifisch, wirken in Biofilmen und beeinflussen die Mikrobiota des Patienten nicht. Eine Phagentherapie kann allerdings nur erfolgreich sein, wenn der Erreger zum Wirtsspektrum des Bakteriophagen gehört.
Um eine langwierige Suche nach dem Erreger und seinem passenden Phagen zu umgehen, bieten sich bei Krankheitsbildern mit definiertem Erregerspektrum Phagenmixturen an. In Phase I befindet sich beispielsweise das Präparat TP102 zur Therapie bei chronisch infizierten Ulzerationen. PP0121, eine Mischung aus 13 verschiedenen Phagen zur Therapie von Infektionen mit E. coli [9], und PP1131 („PhagoBurn“) mit 12 Phagen zur Behandlung von P. aeruginosa bei Brandverletzten, befinden sich in der klinischen Phase-I/II- Prüfung [10]. Alternativ wird auch der Einsatz von Phagenenzymen (Phagolysinen) geprüft: Hierbei handelt es sich um durch Phagen kodierte Proteine mit Enzymcharakter, die eine gezielte, hochspezifische Lyse des Zielorganismus herbeiführen. Als Beispiel sei hier N-Raphasin oder ein rekombinantes Endolysin (HY-133) gegen S. aureus genannt. Letzteres soll gegen eine Nasenkolonisierung durch S. aureus einsetzbar sein.
Antimikrobielle Peptide
Eine weitere vielversprechende Substanzgruppe sind antimikrobielle Peptide, die meist im Rahmen der angeborenen Immunität vom menschlichen Körper gebildet werden. Diese Moleküle bestehen aus nur 15–50 Aminosäuren, die ribosomal synthetisiert und posttranslational modifiziert werden. Etwa 2.000 verschiedene Peptide sind bislang bekannt und werden seit 2003 in der Antimicrobial Peptide Database (http://aps.unmc.edu/AP/main.php) der University Nebraska Medical Center in Omaha gesammelt. Manche Peptide weisen nicht nur antimikrobielle Eigenschaften auf, sondern wirken auch als Immunmodulatoren.