Trillium Diagnostik 2018; 16(4): 233-235
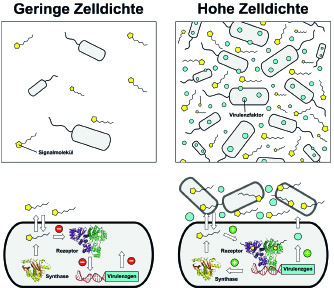
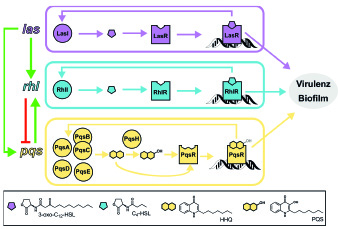
Bakterien sind in der Lage, über kleine Signalmoleküle miteinander zu kommunizieren und dadurch infektionsrelevante Prozesse wie die Bildung von Biofilmen und Virulenzfaktoren zu steuern. Die Unterdrückung dieses Kommunikationsprozesses gilt als vielversprechender Ansatz zur Therapie von Infektionen.
Schlüsselwörter: Quorum sensing, Pseudomonas aeruginosa, Antibiotikaresistenz, Pathoblocker
Während der „goldenen Ära“ der Antibiotikaentwicklung zwischen den 1930er- und 1960er-Jahren glaubte man, mit Antibiotika eine Allzweckwaffe gegen bakterielle Infektionen gefunden zu haben. Doch bereits zu dieser Zeit warnte Alexander Fleming, der mit der Entdeckung von Penizillin als einer der wichtigsten Wegbereiter der modernen Medizin gilt, dass der unbedachte und missbräuchliche Einsatz von Antibiotika die Entstehung von resistenten, pathogenen Bakterien begünstigten könnte. Es sollte sich herausstellen, dass er Recht hatte. Denn momentan befinden wir uns in einer globalen Antibiotika-Krise, in der die Zahl an Antibiotika-resistenten Keimen steigt, während immer weniger neue Wirkstoffe Marktreife erlangen [1, 2]. Diese Krise gilt als eine der großen gesellschaftlichen Herausforderungen des 21. Jahrhunderts, wobei die Ursachen vielfältig sind: Zum einen haben sich aufgrund der hohen Risiken und der immensen Kosten, die mit der Zulassung eines neuen Medikaments verbunden sind, in den letzten Jahren immer mehr Pharmaunternehmen aus der Antibiotikaforschung zurückgezogen; zum anderen ist der Bedarf an Antibiotika nach wie vor sehr hoch. Unter anderem in tierischen Mastbetrieben wird häufig auf Antibiotika zurückgegriffen, um die Entstehung möglicher Krankheiten zu verhindern und damit den Ertrag zu steigern. Die Antibiotika gelangen mit den Ausscheidungen der Tiere größtenteils unverstoffwechselt in die Umwelt, wodurch Bakterien einem erhöhten Selektionsdruck ausgesetzt sind. Dies hat dann zur Folge, dass sich solche Erreger vermehren und ausbreiten können, die beispielsweise durch spontane Mutationen resistent geworden sind [1, 2]. Besonders alarmierend in diesem Zusammenhang ist die Ausbreitung multiresistenter Stämme von humanpathogenen Erregern, die gleichzeitig gegenüber mehreren antimikrobiellen Wirkstoffen resistent sind. Basierend auf den Daten einer aktuellen Studie sind 2015 in Europa mehr als 33.000 Menschen an den Folgen von Infektionen mit antibiotikaresistenten Bakterien gestorben – und es ist momentan keine Besserung in Sicht [3]. Um diesem besorgniserregenden Trend entgegenzuwirken, ruft die Weltgesundheitsorganisation (WHO) seit Jahren zu einem Umdenken im Umgang mit Antibiotika und zur Entwicklung neuer Behandlungsstrategien auf [1, 2].