Aktuelle Studienergebnisse zu dieser Fragestellung liefern die US-amerikanische RxPonder-Studie und die deutsche ADAPT-Studie. Bereits vor einigen Jahren hatte die TAILORx-Studie gezeigt, dass post-menopausale Patientinnen ohne axillären Lymphknotenbefall (N0, RS ≤ 25) keine adjuvante Chemotherapie benötigen [1]. Für die prämenopausalen Patientinnen weist eine retrospektive Analyse im Rahmen der TAILORx-Studie darauf hin, dass bei einem Recurrence-Score (RS) < 16 auf eine adjuvante Chemotherapie verzichtet werden kann.
Adjuvante Chemotherapie beim HR+, HER2– Mammakarzinom mit intermediärem Risiko
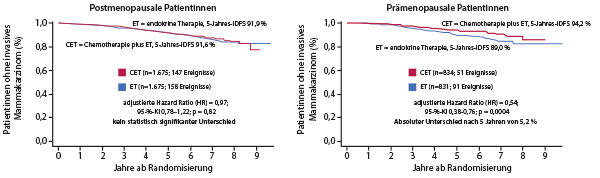
In der Phase-III-Studie RxPonder wurden insgesamt über 5.000 Patientin-nen mit 1–3 befallenen axillären Lymphknoten und einem RS ≤ 25 in zwei Studienarme randomisiert und adjuvant mit einer endokrinen Therapie plus/minus Chemotherapie behandelt. Nach einer medianen Nachbeobachtungszeit von 5,1 Jahren zeigte sich keine Korrelation zwischen der Höhe des RS (0–25) und dem Effekt der Chemotherapie (HR 1,02; p = 0,30 (2-seitig)). Bezogen auf alle Patientinnen hatte die zusätzliche adjuvante Chemotherapie das invasive Rezidivrisiko reduziert (HR 0,81; p = 0,026); dieser Effekt war aber durch die prämenopausalen Patientinnen getriggert, erläuterte Prof. Kevin Kalinsky, Emory Winship Cancer Institute, Georgia/USA. Nach fünf Jahren waren noch 94,2 % der prämenopausalen Patientinnen im Chemotherapie-Arm ohne invasives Rezidiv versus 89,0 % im endokrinen Arm (HR 0,54; p = 0,0004) [2]. Die prognostischen Vorteile der Chemotherapie zeigten sich unabhängig vom axillären Lymphknotenbefall sowie vom RS (0–13 vs. 14–25). Nach fünf Jahren waren noch 98,6 % der prämenopausalen Patientinnen im Chemotherapie-Arm am Leben (vs. 97,3 %; HR 0,47; p = 0,032). Bei den postmenopausalen Patientinnen zeigte sich dagegen in keiner Subgruppe ein klinisch relevanter Unterschied zwischen beiden Studienarmen, so Kalinsky.