Die Forschung zur akuten myeloischen Leukämie (AML) stellt zurzeit eines der spannendsten Gebiete der Hämatologie dar. Die molekulargenetischen Analysen der vergangenen Jahre haben immer tiefere Einblicke in die genetische Heterogenität dieser Erkrankung gebracht und vor allem zahlreiche Mutationen identifiziert, die einerseits pathogenetisch relevant sind und sich andererseits als Angriffspunkte für innovative Therapien eignen. Darüber hinaus kristallisiert sich zunehmend deutlicher heraus, dass der Nachweis der minimalen Resterkrankung mit hochsensitiven Methoden auch bei der AML immer wichtiger für die Prognose und künftig wohl auch für die Therapiesteuerung wird. Bei der Jahrestagung der American Society of Hematology (ASH) im Dezember 2017 in Atlanta wurde zu diesen Themen eine Fülle neuer Daten präsentiert, von denen hier nur eine kleine Auswahl referiert werden kann.
FLT3-mutierte AML: Nutzen einer Midostaurin-Erhaltungstherapie?
In der Phase-III-Studie RATIFY hatte die Behandlung mit dem niedermolekularen FLT3-Inibitor Midostaurin zusätzlich zur Induktions- und Konsolidierungstherapie sowie als einjährige Erhaltungstherapie bei Patienten mit neu diagnostizierter akuter myeloischer Leukämie (AML) und Mutationen im Gen für den FLT3-Rezeptor signifikant progressionsfreies und Gesamtüberleben gegenüber Placebo verlängert [1]. Nur die Patienten, die nach der Induktionstherapie in kompletter Remission waren, hatten die Erhaltungstherapie mit Midostaurin bekommen; in einer separaten Analyse, die Richard Larson, Chicago, in Atlanta präsentierte, wurde die Rolle der Erhaltung beleuchtet [2].
Dazu wurden zwei Landmark-Analysen zum krankheitsfreien Überleben durchgeführt: einmal ab dem Beginn und einmal ab dem Ende der Erhaltungstherapie. In der ersten Analyse mit insgesamt 174 Patienten war ein leichter numerischer, aber nicht signifikanter Vorteil zugunsten des Midostaurin-Arms zu sehen (Hazard Ratio 0,83; p = 0,49). Während der Erhaltungstherapie traten im Midostaurin-Arm 31 Ereignisse auf (30 Rezidive, ein Todesfall), im Placeboarm 22 (alles Rezidive). In der zweiten Analyse zum krankheitsfreien Überleben ab dem Ende der Erhaltungstherapie war ebenfalls kein signifikanter Unterschied zwischen den beiden Armen zu erkennen (HR 1,4; p = 0,38; im Midostaurin-Arm 16 Rezidive, im Plazeboarm sieben Rezidive und zwei Todesfälle). Auch beim Gesamtüberleben ab dem Beginn der Erhaltungstherapie gab es keinen signifikanten Unterschied (HR 0,96 zugunsten von Midostaurin; p = 0,86).
Anhand der Resultate dieser ungeplanten Post-hoc-Subgruppenanalysen lässt sich der Nutzen einer Erhaltungstherapie mit Midostaurin nicht bewerten. Dazu, so Larson, wäre eine Randomisierung speziell für die Erhaltungstherapie erforderlich.
NPM1/FLT3-ITD-Genotyp bestimmt Prognose
Die Prognose von AML-Patienten mit FLT3-ITD-Mutationen ist schlecht, hängt aber auch vom Verhältnis zwischen mutierten und Wildtyp-Allelen ab und ist außerdem im Kontext anderer Mutationen – wie solcher des NPM1-Gens – zu sehen, die sich prognostisch eher günstig auswirken. Das schlägt sich in den aktuellen Empfehlungen des European LeukemiaNet nieder, wo je nach Vorliegen einer NPM1-Mutation bzw. einer hohen (≥ 0,5) oder niedrigen FLT3-ITD- versus -Wildtyp-Allel-Ratio (< 0,5) vier Subgruppen unterschieden werden [3]. In der RATIFY-Studie ergaben sich für 428 Patienten, bei denen diese Merkmale auswertbar waren, nach median etwa fünf Jahren Nachbeobachtung Hinweise auf eine prognostische Rolle insbesondere des FLT3-ITD- zu -Wildtyp-Allel-Verhältnisses, so Konstanze Döhner, Ulm [4]: Auch wenn die Studie nicht gepowert war, um in den relativ kleinen Subgruppen einen Nutzen von Midostaurin nachzuweisen, ergab sich ein positiver Effekt des Kinase-Inhibitors vor allem bei den Patienten mit NPM1-Wildtyp und einer hohen FLT3-ITD- zu -Wildtyp-Allel-Ratio – sowohl beim Gesamtüberleben (median 26 vs. 14 Monate; p = 0,025) als auch beim ereignisfreien Überleben (Median 8 vs. 3 Monate; p = 0,016).
In einer multivariaten Analyse erwiesen sich drei Variable als unabhängige signifikante Prognosefaktoren sowohl für Gesamt- als auch ereignisfreies Überleben, so Frau Döhner: der NPM1/FLT3-ITD-Genotyp (Gesamtüberleben p < 0,0001 bzw. ereignisfreies Überleben p = 0,002), Therapiearm Midostaurin versus Plazebo (p = 0,011 bzw. p = 0,003) und Leukozytenzahlen (p = 0,015 bzw. p < 0,0001). Hingegen wirkte sich eine allogene Stammzelltransplantation nur beim Gesamt- (p < 0,0001) und das Geschlecht nur beim ereignisfreien Überleben aus (p = 0,017).
Gilteritinib verbessert 7 + 3 vor allem bei FLT3-mutierten Patienten
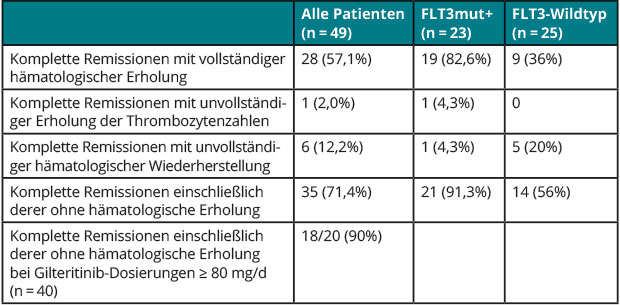
Gilteritinib ist ein potenter neuer Inhibitor, der selektiver als Midostaurin ist und lediglich die FLT3- sowie die ASXL1-Tyrosinkinase hemmt. Bei Patienten mit rezidivierter oder refraktärer AML mit aktivierenden ITD- oder TKD-Mutationen von FLT3 hatte Gilteritinib als Monotherapie in Dosen von 80 mg/d oder mehr Ansprechraten von 52% und mediane Überlebenszeiten von 31 Wochen zur Folge gehabt [5]. In einer US-amerikanischen Phase-I-Studie wurden nun Sicherheit und Wirksamkeit des Inhibitors in Kombination mit einer intensiven Erstlinien-Chemotherapie (7 + 3 mit Cytarabin/Idarubicin) bei Patienten mit neu diagnostizierter AML untersucht [6].
Wie Keith Pratz, Baltimore, berichtete, kam es während der Dosiseskalations-Phase lediglich bei einer Dosierung von 40 mg/d in den ersten zwei Wochen zu zwei dosislimitierenden Toxizitäten (Neutropenie, Thrombozytopenie, verminderte Auswurffraktion). Nach Modifikation des Dosierungsschemas (nicht von Tag 1–14, sondern von Tag 4–17 eines Induktionszyklus) konnte Gilteritinib auf bis zu 120 mg/d erhöht werden, die auch als Dosierung für eine Expansionskohorte gewählt wurden. Auch während der bis zu drei Zyklen einer hochdosierten Cytarabin-Konsolidierung wurde der Inhibitor 14 Tage lang gegeben, anschließend erhielten die Patienten ihn täglich für bis zu zwei Jahre.