Eines der wichtigen Ziele der Therapie bei der chronischen lymphatischen Leukämie (CLL) in klinischen Studien ist mittlerweile die Eradikation einer detektierbaren minimalen Resterkrankung (MRD), weil der Patient dann eine deutlich bessere langfristige Prognose hat – egal, mit welcher Therapie die MRD-Negativität erzielt wurde. Der Nutzen neuer Therapieoptionen wird daher immer häufiger daran gemessen, wie viele Patienten diesen Zustand erreichen. Das wurde ganz deutlich bei der Jahrestagung der American Society of Hematology (ASH) im Dezember 2017 in Atlanta, wo die MRD-Negativität bei den meisten vorgestellten klinischen CLL-Studien ein zentraler Zielparameter war. Auffällig ist außerdem das seit einiger Zeit erkennbare Bemühen um eine zeitliche Begrenzung der Therapie, nicht zuletzt begründet durch die Kosten der neuen Medikamente.
Ein Highlight des Kongresses waren sicherlich aus CLL-Sicht die ersten Resultate der globalen MURANO-Studie, die John Seymour, Melbourne, in der Late-Breaking-Abstracts-Sitzung am letzten Tag präsentierte [1]. Die Kombination aus dem BCL2-Inhibitor Venetoclax und dem CD20-Antikörper Rituximab (VR) war hier dem Bendamustin-Rituximab-Regime (BR) weit überlegen und wird daher in absehbarer Zeit dieses als langjährigen Standard bei der rezidivierten/refraktären CLL ablösen:
Das BCL2-Protein spielt in CLL-Zellen eine wichtige Rolle bei der Verhinderung der Apoptose. Der BCL2-Inhibitor Venetoclax ist bisher zugelassen als Monotherapie bei Patienten mit rezidivierter oder refraktärer CLL nach Chemoimmun- und zielgerichteter Therapie mit BCR-Inhibitoren bzw. bei Patienten mit rezidivierter CLL und 17p-Deletion. Diese Zulassung basierte auf Phase-I- [2] und Phase-II-Daten [3]. Die Chemotherapie-freie Kombination aus Venetoclax und Rituximab hatte in einer Phase-I-Studie bereits hohe Raten an Komplettremissionen erbracht und bei vielen Patienten zum Verschwinden einer minimalen Resterkrankung geführt [4]. MURANO stellt die erste Phase-III-Studie zur Anwendung von Venetoclax bei der rezidivierten oder refraktären CLL dar, wo bisher BR ein Standard war, der auch auf Studien der deutschen CLL-Studiengruppe zurückging [5]. MURANO sollte neben der Wirksamkeit der neuen Kombination auch deren Potenzial ausloten, mit einer zeitlich limitierten Anwendung die Chancen auf ein progressionsfreies Überleben zu verbessern, so Seymour.
Dazu wurden 389 Patienten eingeschlossen, die bis zu drei vorhergehende Therapien erhalten hatten, darunter mindestens eine mit Chemotherapie. Sie mussten entsprechend der iwCLL-Leitlinie [6] erneut therapiebedürftig sein und wurden anhand des Vorliegens einer 17p-Deletion, des Ansprechens auf die letzte vorangegangene Therapie und der geografischen Herkunft stratifiziert. Im VR-Arm wurde Venetoclax über vier bis fünf Wochen von 20 auf 400 mg/d aufdosiert, um das Risiko für ein Tumorlyse-Syndrom zu minimieren. Rituximab wurde ab Woche 6 insgesamt sechsmal in vierwöchigen Abständen infundiert. Venetoclax sollte bis zu einer erneuten Progression der Krankheit bzw. für maximal zwei Jahre gegeben werden. Im BR-Arm erhielten die Patienten Bendamustin und Rituximab jeweils für sechs Zyklen. Primärer Endpunkt war das durch die Prüfärzte festgestellte progressionsfreie Überleben.
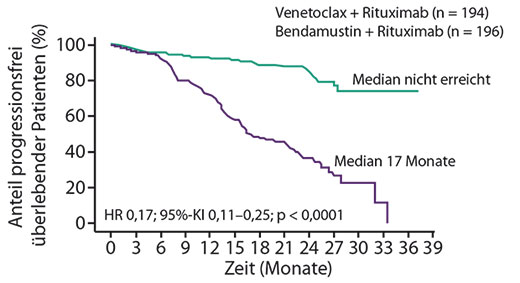
Hier war nach einer medianen Nachbeobachtungszeit von 23,8 Monaten der VR-Arm weit überlegen mit einer Hazard Ratio von 0,17 (95%-Konfidenzintervall 0,11–0,25; p < 0,0001). Der Medianwert war im VR-Arm noch nicht erreicht, im BR-Arm lag er bei 17,0 Monaten (Abb. 1); nach zwei Jahren waren unter VR 84,9%, unter BR lediglich 36,3% der Patienten progressionsfrei am Leben. Diese Wirkung erstreckte sich auf alle untersuchten Subgruppen, insbesondere auch auf die Patienten mit 17p-Deletion und war in der verblindeten Beurteilung durch ein zentrales Expertenkomitee von ähnlicher Größenordnung (HR 0,19).