Die Ära der Immuntherapien im weitesten Sinn begann etwa bei den Lymphomen bereits vor 20 Jahren mit der Einführung von Rituximab; beim Multiplen Myelom hat es deutlich länger gedauert, aber mit Daratumumab und Elotuzumab sind seit wenigen Jahren ebenfalls sehr effektive monoklonale Antikörper im Einsatz. Und für Myelom-Patienten, die gegen alle verfügbaren Therapien refraktär sind, werden jetzt – wie bei akuten Leukämien und Lymphomen – die neuesten „Hightech“-Waffen der Onkologie erprobt: Autologe zytotoxische T-Lymphozyten mit chimären Antigenrezeptoren (CAR-T-Zellen) zeigen in ersten Phase-I-Studie auch hier erstaunliche Wirksamkeit.
Rezidiviertes oder refraktäres Multiples Myelom
POLLUX und CASTOR: Vorteil der Daratumumab-Kombination bestätigt
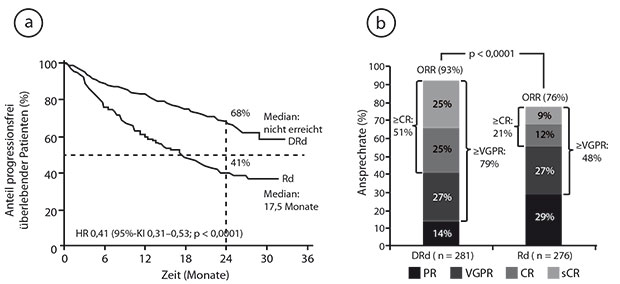
Derzeit ist der CD38-Antikörper Daratumumab unter anderem in der rezidivierten/refraktären Situation in Kombination sowohl mit Lenalidomid/Dexamethason (DRd) als auch mit Bortezomib/Dexamethason (DVd) zugelassen. Erstere Kombination wurde in der Phase-III-Studie POLLUX gegen Rd alleine getestet, wobei sie das progressionsfreie Überleben signifikant verlängern konnte [1]. In Atlanta zeigte Meletios Dimopoulos, Athen, eine aktualisierte Auswertung nach im Median 25,4 Monaten Follow-up [2]:
Beim progressionsfreien Überleben war der Vorteil durch die Dreierkombination weiterhin hochsignifikant mit einer rund 60%igen Reduktion des Risikos (Median unter DRd noch nicht erreicht, unter Rd 17,5 Monate; HR 0,41; p < 0,0001; Abb. 1a). Ebenso beeindruckend war der Unterschied beim Ansprechen mit Raten für das Gesamtansprechen von 93% versus 76% (p < 0,0001 Abb. 1b), für eine mindestens sehr gute partielle Remission von 79% versus 48% (p < 0,0001) und für eine mindestens komplette Remission von 51% versus 21% (p < 0,0001). Bei Patienten ohne nachweisbare minimale Resterkrankung (MRD; bei einer Sensitivität von < 10-5) war das progressionsfreie Überleben unabhängig von der vorangegangenen Therapie länger als bei MRD-positiven Patienten. Der wesentliche Vorteil der DRd-Therapie: Eine MRD-Negativität konnte damit mehr als viermal häufiger erreicht werden als mit Rd (bei 26% vs. 6% der Patienten; p < 0,0001).