Die Lymphom-Therapie stellt seit etwa zwei Jahrzehnten – seit mit Rituximab der erste therapeutische Antikörper eingeführt wurde – eines der produktivsten Gebiete der Onkologie dar, und die Entwicklung neuer Medikamente wurde in den letzten Jahren eher noch beschleunigt. Antikörper, zielgerichtete Therapien, Antikörper-Toxin-Konjugate und zuletzt autologe T-Zellen mit maßgeschneiderten Antigen-Rezeptoren, die sich vielleicht einmal als Konkurrenz zur allogenen Stammzelltransplantation erweisen könnten: Zu all diesen Ansätzen wurden beim weltgrößten Hämatologen-Treffen, der Jahrestagung der American Society of Hematology (ASH) in Atlanta Anfang Dezember 2017 wieder viele spannende Neuigkeiten präsentiert. Wir stellen eine Auswahl interessanter Studienergebnisse zu Non-Hodgkin-Lymphomen vor.
Indolente Lymphome
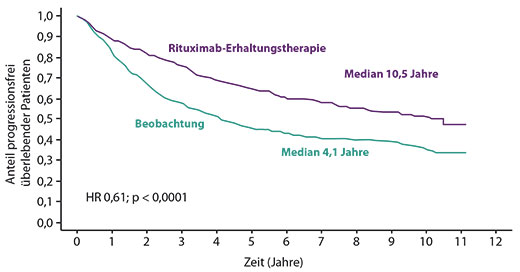
Rituximab-Erhaltung auch nach zehn Jahren noch vorteilhaft
Das follikuläre Lymphom gilt als Prototyp des indolenten Non-Hodgkin-Lymphoms, das zwar durch relativ lange Überlebenszeiten charakterisiert, aber nach wie vor nicht heilbar ist. Als Erstlinientherapie wird bei hoher Tumorlast standardmäßig ein CD20-Antikörper mit einer Chemotherapie (Bendamustin, CHOP oder CVP) gegeben. In den meisten Zentren schließt sich daran bei Patienten, die auf die Induktion angesprochen haben, eine zweijährige Erhaltungstherapie mit Rituximab an. Das basiert auf den Ergebnissen der von der französischen Lymphom-Studiengruppe koordinierten, internationalen PRIMA-Studie: In deren Erstauswertung hatte sich ein Vorteil der Erhaltung gegenüber alleiniger Beobachtung beim progressionsfreien (Hazard Ratio 0,55; p < 0,0001), nicht aber beim Gesamtüberleben (HR 0,87; p = 0,60) ergeben [1]. In Atlanta konnte Gilles Salles, Lyon, nun die 10-Jahres-Daten der Studie vorstellen [2]: