Funktionelle Autoantikörper binden an G-Protein-gekoppelte Rezeptoren (GPCR) und aktivieren dort unkontrolliert Second-messenger-Kaskaden. Diese können sogenannte „functional autoantibody diseases“ auslösen.
Schlüsselwörter: Autoimmunität, funktionelle Autoantikörper, G-Protein-gekoppelte Rezeptoren (GPCR).
Ein funktionierendes Immunsystem ist der Garant für die Unversehrtheit des menschlichen Organismus. Um die individuelle Integrität zu gewährleisten, unterscheidet es zwischen „eigen“ und „fremd“. Als Autoimmunität bezeichnet man den Verlust oder die Einschränkung der Selbsttoleranz – ein Phänomen, das auch gesunde Individuen vor allem im Alter betreffen kann. Aus der überschießenden Autoimmunität resultieren vielfältige Autoimmunerkrankungen, deren Entstehen durch genetische und epigenetische Faktoren sowie Umweltbedingungen begünstigt wird.
„Klassisch“ versus „funktionell“
Mittlerweile ist für Selbstantigene ebenso wie für Fremdantigene akzeptiert, dass diese mit einem Antikörper reagieren und anschließend von zellulären Bestandteilen des Immunsystems zerstört werden. Zusätzlich zu diesen destruktiven – häufig auch als „klassisch“ bezeichneten – Autoantikörpern gibt es eine zweite Klasse, die erst 1977 in Schlüsselexperimenten entdeckt wurde. Diese binden an G-Protein-gekoppelte Rezeptoren (GPCR) und stoßen ganz ähnlich wie physiologische oder pharmakologische Liganden Signalkaskaden an, in deren Folge die Funktion der Zielzellen und letztlich auch die Struktur von Geweben und Organen verändert werden. Diese „GPCR autoantibodies“ (GPCR-AAB) werden im Deutschen als „funktionelle Autoantikörper“ bezeichnet.
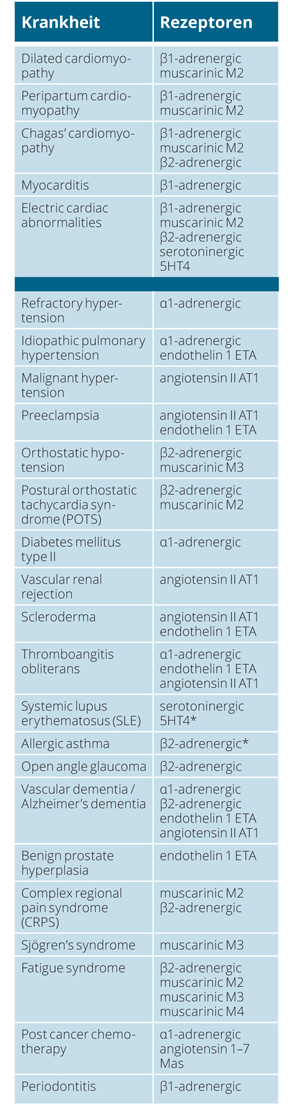
Die pathogenetische Bedeutung der GPCR-AAB wird verständlich, wenn man sich vergegenwärtigt, welchen Stellenwert GPCR im menschlichen Organismus besitzen. Die dazugehörigen Krankheiten können unter „functional autoantibody diseases“ zusammengefasst werden.
G-Protein-gekoppelte Rezeptoren
GPCR gehören zur Superfamilie der heptahelikalen Transmembranproteine, die ca. 80% aller Rezeptoren unseres Körpers ausmachen. Sie sind an der Verarbeitung zahlreicher Signale beteiligt – von Sinnesreizen über die Stoffwechselregulation, Entzündungsprozesse, Chemotaxis, Endo- und Exozytose bis zu Zellwachstum, -differenzierung und -tod.
Vor allem die transmembranöse Signalübertragung vieler glandulärer Hormone, Gewebshormone und Neurotransmitter erfolgt über GPCR. Und wie bei diesen gilt auch für die Bindung extrazellulärer GPCR-AAB, dass „second messenger“-Mechanismen aktiviert werden, durch die Informationen zu den intrazellulären Zielstrukturen gelangen.
In der Zellkultur lassen sich diese Effekte sehr gut demonstrieren. Werden zum Beispiel isolierte, spontan schlagende Herzmuskelzellen einer Ratte mit einer IgG-Fraktion aus dem Blut von Patienten mit Chagas-Kardiomyopathie inkubiert, so steigt deren Kontraktionskraft und Schlagfrequenz. Daraus leitete sich die Vermutung ab, dass diese IgG-Fraktion einen Antikörper enthält, der gegen einen Rezeptor adrenerger Signalwege gerichtet ist. Und tatsächlich konnte als Zielstruktur des Autoantikörpers (β1-AAB) der zu den GPCR gehörende β1-adrenerge Rezeptor identifiziert werden.
Ähnlich funktioniert der TSH-Rezeptor-Autoantikörper (TRAK), der nahezu zeitgleich im Blut von Patienten mit Morbus Basedow entdeckt wurde. Nach Bindung an humane Schilddrüsenmembranen nimmt deren cAMP-Produktion zu, wobei die extrazelluläre N-terminale Domäne desG-Protein-gekoppelten TSH-Rezeptors als Bindungsort identifiziert werden konnte. Heute sind sowohl stimulierende als auch hemmende und neutralisierende TRAK bekannt. GPCR-AAB vom β1-AAB-Typ binden im Unterschied zu TRAK an die extrazellulären Rezeptorloops der GPCR.