Von mesenchymalen Stromazellen abgegebene extrazelluläre Vesikel haben das Potenzial, als nebenwirkungsarme, einfach zu handhabende zellfreie Therapeutika in der regenerativen Medizin eingesetzt zu werden. Der Weg in die Klinik scheint vorgezeichnet, für die Labormedizin bietet sich eine reiche Palette neuer Testmethoden.
Schlüsselwörter: Extrazelluläre Vesikel, mesenchymale Stromazellen, Immunmodulation, klinische Studien
In einer Reihe von präklinischen und klinischen Studien wurde gezeigt, dass mesenchymale Stromazellen (MSC) bei verschiedenen Krankheitsbildern regenerativ wirken können. Der zugrunde liegende Mechanismus ist noch weitestgehend unbekannt. Einerseits vermutet man, dass MSC im Körper – ebenso wie in der Zellkultur – zu Knochen-, Knorpel-, Fett- und anderen Zelltypen differenzieren können, andererseits scheint der therapeutische Effekt vor allem auch parakriner Natur zu sein, denn die nachweisbaren Einbauraten der Zellen in das Zielgewebe sind gering.
Gesichert ist, dass MSC Wachstumsfaktoren und Zytokine mit proliferationsfördernder sowie immunmodulatorischer Wirkung an ihre Umgebung abgeben, und zwar sowohl frei löslich als auch verpackt in extrazelluläre Vesikel (EV). Bei letzteren handelt es sich um membranumhüllte Partikel im Größenbereich von einigen Nanometern bis zu einem Mikrometer. Sie können eine Reihe von bioaktiven Molekülen (Nukleinsäuren, Lipide, Proteine) zur Kommunikation zwischen Zellen transportieren.
Therapeutisches Potenzial
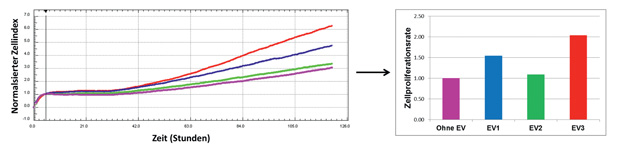
Gerade diese MSC-EV scheinen für einen Teil der therapeutischen Wirkung verantwortlich zu sein. In eigenen Experimenten konnten wir proliferationsfördernde Wirkungen auf unterschiedliche Zielzellen zeigen (Abb. 1).