
In engen Grenzen zugelassen
Präimplantationsdiagnostik in Deutschland
Die Präimplantationsdiagnostik (PID) wird im Rahmen der In-vitro-Fertilisation durchgeführt, um bei vorbelasteten Paaren das Risiko des Kindes für eine schwere erbliche Erkrankung zu reduzieren. Neben technischen sind vor allem auch rechtliche und ethische Aspekte zu berücksichtigen.
Schlüsselwörter: Präimplantationsdiagnostik, Polkörperbiopsie, PCR, NGS
Seit Kurzem ist in Deutschland in engen Grenzen eine Präimplantationsdiagnostik möglich. Den gesetzlichen Rahmen geben das Präimplantationsdiagnostikgesetz (PräimpG) vom Dezember 1990 und die Verordnung zur Regelung der Präimplantationsdiagnostik (PIDV) vom Februar 2013 vor. Inzwischen haben fast alle Bundesländer die PIDV umgesetzt und Ethikkommissionen ihre Arbeit aufgenommen.
Eine PID kann Paaren angeboten werden, die durch ihre genetische Disposition ein hohes Risiko für Nachkommen mit einer schweren Erbkrankheit oder einer schwerwiegenden Schädigung des Embryos haben. Voraussetzung ist zum einen die eindeutige Identifizierung der krankheitsverursachenden DNA-Veränderung und zum anderen eine assistierte Reproduktion mit intrazytoplasmatischer Spermieninjektion (ICSI). Auf Antrag der Frau bzw. des Paares entscheidet die zuständige Ethikkommission im Einzelfall, ob eine PID zulässig ist.
Medizinischer Hintergrund
Sind Eltern Anlageträger für eine schwere, genetisch bedingte Erkrankung oder besteht bei der Weitergabe ihrer Erbanlagen eine erhöhte Wahrscheinlichkeit für einen unbalancierten Chromosomensatz, so existiert für deren Nachkommen ein erhöhtes Erkrankungsrisiko. Dieses Risiko kann in den meisten Fällen durch eine Polkörper-, Präimplantations- und/oder pränatale Diagnostik weitgehend minimiert werden.
Die frühestmögliche genetischen Untersuchung ist eine Polkörperdiagnostik (PKD, sog. Präfertilisationsdiagnostik) unmittelbar vor Abschluss der Befruchtung. Sie lässt nur Rückschlüsse auf die in der Eizelle verbliebenen mütterlichen Erbanlagen zu; eine Beurteilung des väterlichen Erbguts ist mit dieser Methode nicht möglich.
Bei der eigentlichen Präimplantationsdiagnostik werden Zellen des Embryos nach einer In-vitro-Fertilisation (IVF) mittels intrazytoplasmatischer Spermieninjektion unmittelbar vor dem intrauterinen Transfer molekulargenetisch untersucht und dabei sowohl mütterliche als auch väterliche Erbanlagen des Embryos sichtbar. Paare, bei denen ein oder beide Partner Anlageträger für eine schwere genetisch bedingte Erkrankung sind, haben häufig kein Fertilitätsproblem; sie würden vielmehr assistierte Reproduktionstechniken in Anspruch nehmen, um zu wissen, ob der Embryo die zur Erkrankung führende genetische Anlage trägt.
Die wichtigste Voraussetzung, um eine PID überhaupt durchführen zu können, ist die eindeutige Identifizierbarkeit der Veränderung des Erbgutes, die bereits
intrauterin oder postnatal zu einer schweren, nicht behandelbaren Erkrankung führt. Das betrifft zum einen Paare, bei denen die Frau aufgrund einer strukturellen Chromosomenaberration bei einem der Partner (z. B. balancierte Translokation oder Inversion) schon mehrfach Fehl- oder Totgeburten hatte. Zum anderen sind es Paare, die aufgrund klar identifizierbarer Mutationen ein hohes Risiko haben, dass ihr Kind intrauterin oder bald nach der Geburt an einer schweren, evtl. zum Tod führenden erblichen Störung erkranken wird. Nicht selten leben Eltern bereits mit einem schwerkranken Kind und möchten das erneute Auftreten der Erkrankung bei einem Geschwisterkind unbedingt ausschließen.
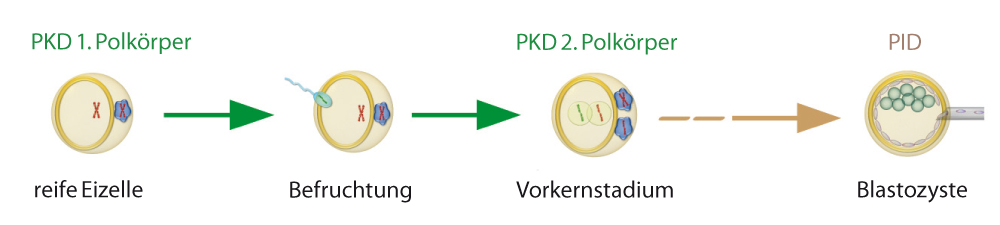
Technische Aspekte der PKD/PID
Polkörperbiopsie:Zum Ausschluss einer monogenen Erkrankung werden die beiden Polkörper einer Eizelle (1. Polkörper nach Meiose I und 2. Polkörper nach Befruchtung der Eizelle, Meiose II) sequenziell entnommen und deren genetische Konstitution bestimmt (Abb. 1). Befinden sich die beiden mutationstragenden Allele in den Polkörpern, ist davon auszugehen, dass die Eizelle frei von der Mutation ist und zu einem nicht betroffenen Embryo führt. Die Vor- und Nachteile der verschiedenen Biopsiemethoden werden bei Hehr et al.[1] aufgezeigt.
Biopsie von Trophektodermzellen: Alle derzeit im Rahmen einer PID angewandten Untersuchungsmethoden setzen eine DNA-Amplifikation durch PCR voraus. Um bei der Biopsie von Trophektodermzellen das Kontaminationsrisiko durch Spuren von Spermien-DNA zu minimieren, muss die Befruchtung der Eizelle vor einer PID obligat durch ICSI erfolgen. Zur Gewinnung des Untersuchungsmaterials wird durch die kooperierende reproduktionsmedizinische Einrichtung eine Blastozystenbiopsie durchgeführt. Hierbei entnimmt der Embryologe aus der fünf Tage alten Blastozyste ca. vier bis acht Zellen des Trophektoderms. Der Embryoblast ist somit nicht von der Intervention betroffen. Da der Embryotransfer spätestens am Tag 6 nach Follikelpunktion erfolgen muss, ist das Zeitfenster für die PID mit 24 Stunden sehr eng.
Bei einer technisch besonders komplizierten PID kann mehr Zeit gewonnen werden, wenn eine Vitrifikation (Kryokonservierung) von Blastozysten vorgenommen wird. Bei Embryonen mit geringem Entwicklungspotenzial kann ein Embryotransfer nach einer sog. späten Tag-3-Biopsie (Embryo mit mehr als acht Zellen) sinnvoll sein, da diese Embryonen oft das Blastozystenstadium (Tag 5) in der Kultur nicht erreichen. Bei allen Biopsietechniken muss berücksichtigt werden, dass ausschließlich pluripotente, nicht aber totipotente Zellen mittels PID untersucht werden dürfen.
PID von Aneuploidien: Chromosomale Aberrationen werden nach Gesamtgenomamplifikation (Whole Genome Amplification, WGA) der Trophektoderm-DNA mittels vergleichender genomischer Hybridisierung (Array-CGH) oder durch Next Generation Sequencing (NGS)[2] auf unbalanciertes Vorliegen beim Embryo überprüft. Neben den Translokationschromosomen kann man bei Anwendung dieser Techniken zusätzlich alle anderen auftretenden Aneuploidien erkennen. Dadurch ist es möglich, auch einen sog. inter-chromosomalen Effekt einer Translokation zu identifizieren. Grundsätzlich sollte das Auftreten von Aneuploidiemosaiken im Trophektoderm beachtet werden[3]. Die Detektierbarkeit solcher Mosaike hängt entscheidend davon ab, in welchem Verhältnis das Mosaik repräsentiert ist.
PID von monogenen Erkrankungen: Die Durchführung einer PID bei einer monogenen Erkrankung erfordert derzeit die Entwicklung eines patientenspezifischen Testsystems. Generalisierende Methoden wie die SNP-Array-Technologie (Karyomapping[4]) halten nur zögerlich Einzug in die PID-Analytik; ein Grund hierfür ist die ungleichmäßige Abdeckung der einzelnen Gene durch SNPs. Deshalb ist ein zielgerichteter Nachweis der krankheitsverursachenden Mutation weiterhin wichtig.
Das individuelle Testsystem beinhaltet sowohl den zielgerichteten Mutationsnachweis bei dem Paar – möglichst inklusive weiterer betroffener oder nicht betroffener Familienangehöriger – als auch die Identifikation von Mikrosatelliten-Markern in unmittelbarer Nähe des von der Mutation betroffenen Gens. Sie weisen bei der Frau und ihrem Partner individuell unterschiedliche Allelgrößen auf (sog. polymorphe Marker). Auf diese Weise entsteht zusammen mit der spezifischen Krankheits-assoziierten Mutation ein familienspezifisches PID-System.
Vor der Anwendung des PID-Systems an Trophektodermzellen muss dessen Reproduzierbarkeit und Robustheit im Rahmen einer Validierung an Einzelzellen überprüft werden. Kriterien sind dabei die Kontaminationsgefahr, PCR-Amplifikationseffizienz und ADO-Rate (Allelic Dropout) sowie der Zeitbedarf für die Durchführung des PID-Systems.
Ein totales Amplifikationsversagen darf bei maximal 10% aller durchgeführten Amplifikationsreaktionen auftreten, ADO betrifft ca. 5–10% aller Einzelzellamplifikationen. Die gleichzeitige Untersuchung eines mutierten Locus und flankierender gekoppelter polymorpher Marker in einer Multiplex-Nested-PCR, und damit die Bestimmung des Geno- und Haplotyps des Embryos hilft, eine Fehldiagnose aufgrund von ADO und genetischer Rekombination zu vermeiden.
Dazu ist jedoch auch die Bestätigung des ermittelten Haplotyps an mindestens zwei meiotischen Produkten des Indexpatienten oder dessen Eltern notwendig. So kann ein initial rekombinanter Haplotyp identifiziert werden, dessen Verwendung im Rahmen einer PID mit falschen Genotypisierungsergebnissen einhergehen würde.

Dr. rer. nat. Annett Wagner
Zentrum für Humangenetik und
Laboratoriumsdiagnostik (MVZ)
Dr. Klein, Dr. Rost und Kollegen

