Deutschlandweites Screening-Programm
Zystische Fibrose
Die zystische Fibrose gehört zu den häufigsten angeborenen Stoffwechselerkrankungen. Rechtzeitige Diagnose und früher Therapiebeginn können die gesundheitlichen Folgen des Defekts deutlich reduzieren. Seit September 2016 gibt es ein deutschlandweites Screeningprogramm mit einem dreistufigen Diagnoseschema.
Schlüsselwörter: Zystische Fibrose, immunreaktives Trypsin, Pankreas-assoziiertes Protein, Schweißtest
Kinder mit zystischer Fibrose (abgekürzt CF für cystic fibrosis) kann man durch ein gezieltes Neugeborenen-Screening (NGS) identifizieren und somit frühzeitig einer Therapie zuführen. Diese Vorsorgemaßnahme führt vor allem zu einer besseren körperlichen Entwicklung und Lungenfunktion. Die Letalität in den ersten zehn Lebensjahren kann dadurch um fünf bis zehn Prozent gesenkt werden.
Als Ursache für die Mukoviszidose kennt man verschiedene Mutationen des CFTR-Gens, das auf Chromosom 7 liegt und für den in der Zellmembran lokalisierten Chloridkanal cystic fibrosis transmembrane regulator (CFTR) kodiert. Betroffen sind vor allem exokrine Drüsen in Lunge, Bauchspeicheldrüse, Leber und Geschlechtsorganen. Ihre Sekrete werden aufgrund mangelhafter osmotischer Wasseraufnahme zähflüssig und führen so zu dauerhaften Organschäden.
Die Mutation ΔF508 ist mit einer Häufigkeit von ca. 50% in Südeuropa, 90% in den nördlichsten Teilen Westeuropas und 70% in Nordamerika[3] die häufigste CF-verursachende Mutation. Hier fehlt an der Stelle 508 die Aminosäure Phenylalanin aufgrund einer Deletion von drei Nukleotiden[1, 2]. Daneben wurden mittlerweile jedoch mehr als 2.000 weitere Mutationen des CFTR-Gens identifiziert[4, 5].
Wegen der anfänglich meist unspezifischen Beschwerden wird die Diagnose ohne CF-NGS im ersten Lebensjahr nur in 58% der Fälle gestellt. Bei späterem Diagnosealter sind oft bereits irreversible Schäden an der Lunge nachweisbar. Deshalb ist es naheliegend, eine systematische Vorsorgeuntersuchung anzubieten; in insgesamt elf Ländern Europas ist dies bereits im Rahmen der Neugeborenen-Regelversorgung der Fall.
In Deutschland war Mecklenburg-Vorpommern – neben lokalen Studien in Heidelberg und Dresden – Vorreiter für ein CF-Screening auf der Ebene eines ganzen Bundeslandes. An der Universitätsmedizin Greifswald wurde es 2012 im Rahmen eines EU-geförderten Forschungsprojekts (Interreg IVa) etabliert und umfasst mittlerweile über 55.000 untersuchte Neugeborene.
Die bundesweite Implementierung gestaltete sich indes schwierig: Zwischen der Antragstellung beim Gemeinsamen Bundesausschuss (G-BA) im Jahre 2008 und dem Beschluss über die bundesweite Einführung des CF-NGS zum 1.9.2016 vergingen volle acht Jahre. Nun aber kann die Untersuchung auch in Deutschland flächendeckend angeboten werden.
Praktisches Vorgehen
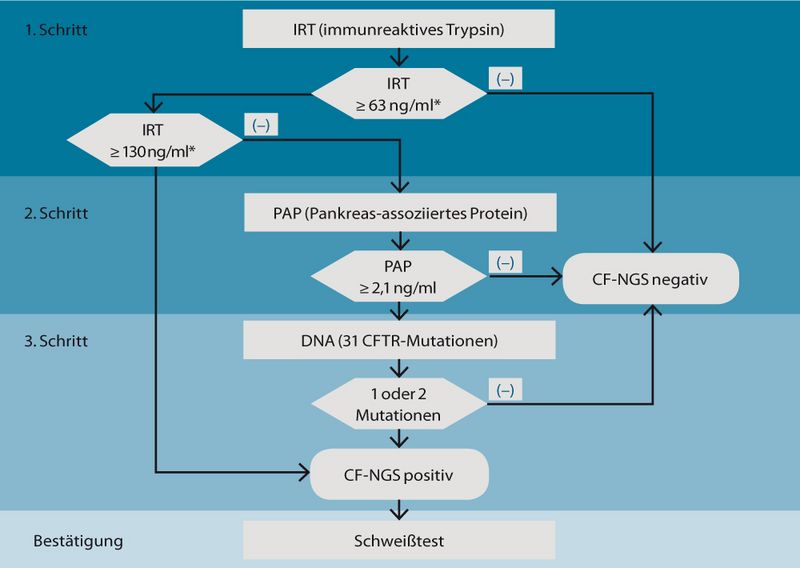
Das Screening auf Mukoviszidose erfolgt entsprechend der neu gefassten Kinderrichtlinie[6] dreistufig als serielle Kombination von zwei biochemischen Tests und einer DNA-Mutationsanalyse aus der gleichen Trockenblutkarte, aus der auch das reguläre Neugeborenen-Screening durchgeführt wird (siehe Abb. 1).
Im ersten Schritt erfolgt die Bestimmung des immunreaktiven Trypsins (IRT). Bei Überschreitung der 99ten Perzentile (63 ng/ml auf Basis der 55.000 Neugeborenen in Mecklenburg Vorpommern[7]) schließt sich die Messung des Pankreatitis-assoziierten Proteins (PAP) aus der gleichen Trockenblutkarte an. Liegt der PAP-Wert über 2,1 ng/ml
(87,5te Perzentile), so folgt als dritte Stufe die genetische Untersuchung auf eine der 31 festgelegten Mutationen. Laut Kinderrichtlinie entfallen im Rahmen einer Fail-Safe-Strategie die Screening-Schritte zwei und drei, wenn der initiale IRT-Wert 130 ng/ml (99,9te Perzentile) überschreitet.
Befund
Das CF-NGS gilt also als positiv, wenn entweder der IRT-Wert über der 99,9ten Perzentile liegt oder mindestens eine Mutation des CFTR-Gens detektiert wurde. In allen anderen Konstellationen gilt das Screening als negativ. Das Labor teilt dem Einsender lediglich ein positives oder negatives Ergebnis mit, nicht aber Einzelheiten zum Ergebnis der DNA-Mutationsanalyse, z. B. welche Mutationen gefunden wurden[6]. Die zeitlichen Vorgaben zielen auf eine Befundübermittlung nach spätestens 14 Tagen ab.
Im Falle eines positiven CF-NGS schließt sich als Konfirmationsdiagnostik ein Schweißtest an, der in einer zertifizierten Mukoviszidose-Ambulanz leitliniengerecht nach der quantitativen Gibson-Cooke-Pilocarpin-Iontophorese (Macroduct®) mit Chloridbestimmung durchgeführt werden soll[7, 9]. Im Vergleich zur Leitfähigkeitsmessung liefert diese Messung der Chlorid-Ionen verlässlichere Werte[8]. Eine Chlorid-Ionenkonzentration über 60 mmol/l in zwei unabhängigen Messungen weist auf eine Mukoviszidose hin; Werte zwischen 30 und 60 mmol/l gelten als Graubereich und benötigen eine weiterführende Diagnostik; bei Chlorid-Ionenkonzentrationen unter 30 mmol/l gilt eine CF als unwahrscheinlich.
Um dem Einsender und auch den betroffenen Eltern eine Hilfestellung zu geben, empfiehlt die Richtlinie, bei der Befundübermittlung Informationen zu spezialisierten Einrichtungen in erreichbarer Nähe des Einsenders vorzuhalten.
Offene Fragen
Durch das CF-NGS verbessert sich die Gesundheitsvorsorge für die Neugeborenen in Deutschland deutlich. Trotzdem bleiben noch Fragen offen: Zum einen konnten vor der Einführung Hebammen oder Entbindungspfleger, die eine Geburt leiteten, über das NGS aufklären und – mit der Möglichkeit zur Rücksprache mit einem Arzt – selbstständig durchführen. Dies gilt nun nicht mehr, sodass zu klären ist, wie Neugeborene das ihnen zustehende CF-NGS erhalten, wenn sie ohne ärztliches Beisein zur Welt kommen. Zwar kann die Untersuchung prinzipiell bis zum Alter von vier Wochen im Rahmen der U2 oder U3 nachgeholt werden, doch das bedeutet eine erneute Blutentnahme und birgt das Risiko des Vergessens. Gerade im Hinblick auf das noch nicht vollständig umgesetzte CF-Tracking ist dies kritisch zu sehen. Es sollte oberstes Ziel sein, sicherzustellen, dass wirklich jedes Neugeborene am CF-NGS teilgenommen und im Falle eines positiven Befundes die entsprechende Konfirmationsdiagnostik durchlaufen hat.
Zum anderen steht das ohnehin bereits unterfinanzierte NGS seit der Erweiterung um das CF-NGS noch weiter unter Druck. Für die Vergütung im ambulanten Bereich fehlt aktuell noch die entsprechende EBM-Ziffer, und die vorgeschlagene Vergütung im stationären Bereich deckt die Kosten des CF-Screenings nicht einmal annähernd.
Die Kinderrichtlinie sieht eine Evaluation drei Jahre nach Inkrafttreten des CF-NGS vor. Ihre Ergebnisse werden eine gute Chance bieten, eventuell notwendige Anpassungen oder Änderungen vorzunehmen.

Dr. rer. nat. Theresa Winter
Universitätsmedizin Greifswald,
Institut für Klin. Chemie und Laboratoriumsmedizin

