In der Therapie der chronischen lymphatischen Leukämie (CLL) hat es in den letzten zehn Jahren mehr Veränderungen gegeben als zuvor in Jahrzehnten, und die Dynamik dieser Entwicklung nimmt weiter zu, wie zuletzt bei der Jahrestagung der American Society of Hematology (ASH) im Dezember 2018 zu erkennen war: Dort wurden mehrere Studien vor allem zur Erstlinientherapie präsentiert, die die Behandlung unserer Patienten in der Praxis erneut verändern werden.
Schlüsselwörter: chronische lymphatische Leukämie, CLL, Erstlinientherapie, Rezidivtherapie, CD20-Antikörper, BTK-Inhibition, Bcl2-Inhibition, CAR-T-Zellen
Erstlinientherapie
Die Einführung zielgerichteter Therapien mit Inhibitoren der Bruton-Tyrosinkinase (BTK), Phosphoinositol-3-Kinase (PI3K) und des anti-apoptotischen Proteins Bcl2 hat die Rezidiv- und mittlerweile auch die Erstlinientherapie der CLL in den vergangenen Jahren geradezu revolutioniert. Drei beim ASH-Kongress vorgestellte große Phase-III-Studien sind geeignet, den BTK-Inhibitor Ibrutinib fest in der Erstlinientherapie zu etablieren:
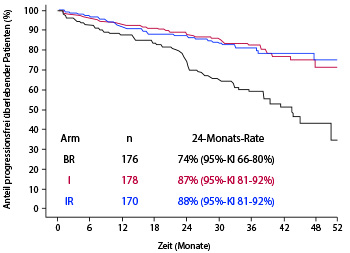
• Die Standard-Erstlinientherapie der CLL war bislang eine Chemoimmuntherapie – bei fitten, jüngeren Patienten mit Fludarabin, Cyclophosphamid und Rituximab (FCR), bei älteren die weniger aggressive Kombination aus Bendamustin und Rituximab (BR), und bei komorbiden Patienten wird der Zweitgenerations-CD20-Antikörper Obinutuzumab mit Chlorambucil gegeben. In der großen internationalen ALLIANCE-Studie wurde nun bei 547 älteren Patienten (≥ 65 Jahre) mit nicht vorbehandelter CLL das BR-Regime randomisiert gegen die Kombination aus Ibrutinib (420 mg/d bis zur Progression) und Rituximab sowie gegen Ibrutinib alleine getestet [1].
Beim primären Endpunkt des progressionsfreien Überlebens, so Jennifer Woyach, Columbus, in der Plenarsitzung des Kongresses, waren die beiden Arme ohne Chemotherapie dem BR-Arm signifikant überlegen, mit einer Hazard Ratio von 0,39 (Ibrutinib-Monotherapie; p < 0,001) bzw. 0,38 (Ibrutinib/Rituximab; p < 0,001; Abb. 1). Die Ergebnisse für die beiden experimentellen Arme waren praktisch identisch, sodass Ibrutinib sich als neuer Standard in der Erstlinientherapie bei diesen Patienten anbietet, während der CD20-Antikörper in dieser Indikation entbehrlich erscheint. Einschränkend muss allerdings gesagt werden, dass Patienten mit günstiger Prognose, beispielsweise mit mutiertem IGVH, nicht von den neuen Therapieoptionen zu profitieren schienen: Bei ihnen war BR bezüglich des progressionsfreien Überlebens genauso wirksam wie die Ibrutinib-haltigen Protokolle. Beim Gesamtüberleben ist nach median 38 Monaten Nachbeobachtungsdauer noch kein Unterschied zu erkennen. Die Daten wurden zeitgleich mit dem Vortrag beim Kongress auch voll publiziert [2].
Da die Toxizität von Ibrutinib nicht zu vernachlässigen ist (Vorhofflimmern und Hypertonus waren signifikant häufiger als unter BR), ist eine engmaschige Kontrolle bei diesen älteren Patienten unerlässlich, und es sollten Woyach zufolge Strategien entwickelt werden, mit denen sich die Therapiedauer begrenzen lässt. Das wird aber mit Ibrutinib als Monotherapie oder in Kombination mit Rituximab kaum gelingen, denn in diesen beiden Armen war in der ALLIANCE-Studie der Anteil der Patienten, bei denen keine minimale Resterkrankung (MRD) mehr nachweisbar war, deutlich geringer (1% bzw. 4%) als unter dem BR-Protokoll (8%).