Schlüsselwörter: HER+ Mammakarzinom, pathologische Komplettremission, neoadjuvante Therapie, post-neoadjuvante Therapie, Trastuzumab Emtansin, T-DM1, endokrine Therapie, Aromatase-Inhibitoren, Lebensstil, Sport
Klinische Relevanz werden die ersten Ergebnisse der randomisierten Phase-III-Studie KATHERINE für Patientinnen mit frühem HER2-positivem (HER2+) Mammakarzinom haben, die unter neoadjuvanter Chemotherapie plus gegen HER2-gerichteter Behandlung keine pathologische Komplettremission (pCR) erzielt haben. Diese sogenannten „non-pCR“-Patientinnen profitierten nach einer medianen Nachbeobachtungszeit von 41 Monaten signifikant von der post-neoadjuvanten Weiterbehandlung mit Trastuzumab Emtansin (T-DM1) im direkten Vergleich mit der post-neoadjuvanten Gabe von Trastuzumab.
T-DM1 – eine post-neoadjuvante Option bei „non-pCR“
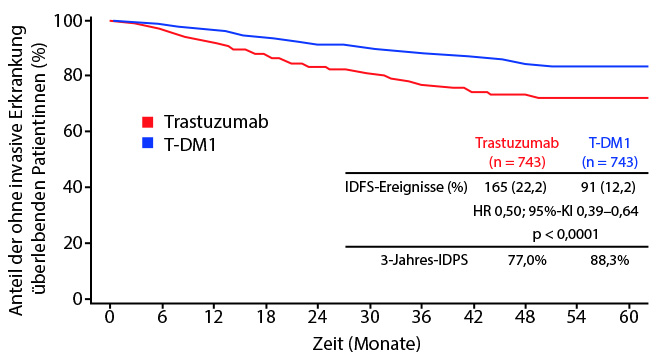
In die KATHERINE-Studie wurden insgesamt 1.486 Patientinnen mit frühem HER2+ Mammakarzinom (cT1–4 N0–3, M0) aufgenommen [1]. Sie hatten unter neoadjuvanter Behandlung mit mindestens sechs Zyklen Taxan-basierter Chemotherapie plus/minus Anthrazyklin sowie zusätzlicher gegen HER2-gerichteter Behandlung (Trastuzumab ± Pertuzumab) keine pCR erreicht. Primärer Studienendpunkt war das Überleben frei von einem invasiven Mammakarzinom-Rezidiv. Nach drei Jahren lag die Rate der „non-pCR“-Patientinnen ohne ein solches invasives Rezidiv im T-DM1-Arm statistisch signifikant höher als im Trastuzumab-Arm (88,3% vs. 77%; Hazard Ratio 0,50; p < 0,0001; Abb. 1). Der absolute Vorteil beim invasiven krankheitsfreien Überleben (iDFS) von 11,3% nach drei Jahren war damit deutlicher als erwartet: Ursprüngliches Ziel war es gewesen, nach drei Jahren einen absoluten Vorteil von 6,5% zugunsten der T-DM1-Gabe zu erreichen.
In den Subgruppenanalysen zeigte sich der iDFS-Vorteil unter anderem unabhängig vom Hormonrezeptor-Status, der Größe des Resttumors und unabhängig davon, ob neoadjuvant Trastuzumab oder zusätzlich Pertuzumab eingesetzt worden war, erläuterte Prof. Charles
Geyer, VCU Massey Cancer Center, Richmond/USA. Das prognostisch besonders wichtige Fernmetastasierungsrisiko war im T-DM1-Arm deutlich reduziert. Nach drei Jahren waren noch 89,7% der mit T-DM1 weiterbehandelten Frauen ohne Fernmetastasen versus 83% derer im Kontrollarm (HR 0,60).
Die Daten zum Gesamtüberleben sind laut Geyer noch nicht reif. Hier deutet sich ein Überlebensvorteil für die Patientinnen im T-DM1-Arm an, der aber noch nicht signifikant ausfällt (HR 0,70; p = 0,0848). Das Nebenwirkungsprofil entsprach dem, was von T-DM1 aus der metastasierten Situation bekannt ist. Im Vergleich mit Trastuzumab lag die Rate der Nebenwirkungen vom Grad ≥ 3 etwa 10% höher als im Trastuzumab-Arm (25,7% vs. 15,4%). Diese waren aber in der Regel klinisch handhabbar.
Fazit: Derzeit ist T-DM1 nur für die metastasierte Situation zugelassen. Die Ergebnisse zum post-neoadjuvanten Einsatz sind aber laut Geyer so vielversprechend, dass davon auszugehen sei, dass es sich als neuer Therapiestandard beim HER2+ Mammakarzinom für „non-pCR“-Patientinnen nach neoadjuvanter Systemtherapie etablieren wird. Laut Prof. Eric Winer, Dana-Farber Cancer Institute, Boston/USA, der die Daten als unabhängiger Experte kommentierte, stützen die Daten das neoadjuvante Therapiekonzept, das es ermögliche, Patientinnen mit suboptimalem Ansprechen und erhöhtem Rückfallrisiko zu identifizieren. Im weiteren Verlauf lasse sich die Therapie individuell anpassen und die Prognose der Frauen verbessern.