Analysen mit digitaler Pathologie und künstlicher Intelligenz
Die Präzisionsonkologie erfordert viele diagnostische Informationen. Mit der permanenten Zunahme der Biomarker für zielgerichtete oder immunonkologische Therapien wachsen die Arbeitsbelastung, die Anforderungen und der Zeitdruck in der Pathologie parallel zu den generierten Datenmengen. Die Biomarkeranalyse im Gewebe erfolgt heute schon zu einem großen Teil digital. „Die digitale Pathologie steckt nicht mehr in den Kinderschuhen, sie ist in der Routinediagnostik angekommen“, konstatierte Professor Christopher Poremba, Pathologie München-Nord. Ein Beispiel aus der täglichen Routine sei die Bestimmung des KI-67-Scores eines Tumors, die mithilfe eines KI-67-Quantifiers ausgeführt und nicht mehr per Hand ausgezählt wird. Gewebeträger werden in der digitalen Pathologie vom Gewebescanner eingescannt und in den automatisierten Mikroskopen prozessiert. Am Monitor erfolgt dann die Befundung der groß und in extrem hoher Auflösung dargestellten Gewebeschnitte.
Dass die digitale Pathologie in der Routine-Diagnostik immer wichtiger wird, liegt auch an einem Ungleichgewicht von Angebot und Nachfrage. Die Arbeitsbelastung von Pathologen steigt aufgrund der alternden Gesellschaft mit immer mehr Tumorerkrankungen und den Anforderungen der Präzisionsmedizin ständig an; auf der anderen Seite gibt es nicht genügend ausgebildete Fachkräfte. „Hier gibt es ein Nachwuchsproblem“, erklärte Volker Bruns vom Fraunhofer-Institut für Integrierte Schaltungen (IIS) in Erlangen mit Blick auf aktuelle Daten der Bundesärztekammer. Die digitale Pathologie biete erhebliche Möglichkeiten der Arbeitserleichterung: Therapieentscheidungen können direkt auf dem Slide gespeichert werden, die digitalisierten Gewebeschnitte sind online von überall für verschiedene Mitarbeiter zugänglich („Telepathologie“) und Algorithmen helfen bei der Analyse der Probe und der Berechnung von Scores.
Künstliche Intelligenz zur Bilderkennung
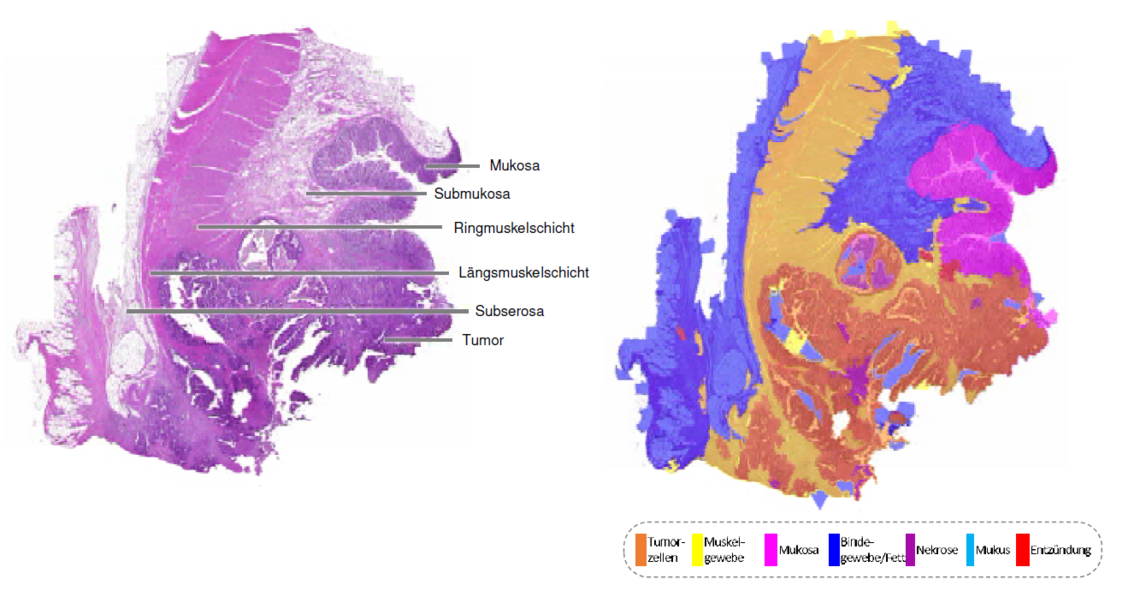
Bruns zeigte vor allem das Entwicklungspotenzial von digitaler Pathologie im Zusammenspiel mit künstlicher Intelligenz (KI) auf. Ein wichtiges Einsatzgebiet der KI in der Pathologie ist die Bilderkennung. „Im Bereich der Bildanalyse kann uns der Computer gut das Zählen von Zellen abnehmen.“ Ein Projekt am IIS ist die Tissue Cartography, also die Gewebeanalyse, speziell beim Darmkrebs, bei der Querschnitte der Dickdarmwand mit ihren typischen Gewebeschichten analysiert werden (Abb. 1).