Humane Papillomaviren (HPV) sind vor allem als Auslöser von Gebärmutterhalskrebs bekannt. Seit einigen Jahren verdichten sich Hinweise, dass auch bestimmte Kopf-Hals-Tumoren durch HPV-Hochrisikotypen verursacht werden. Daher empfiehlt die Stiko ganz aktuell in einer Vorab-Info vom 07.06.2018 die Impfung gegen HPV für Jungen und Mädchen.
Schlüsselwörter: HPV, Zervixkarzinom, Oropharynxkarzinom, HPV-Impfung
Humane Papillomaviren (HPV) bilden eine große Gruppe unbehüllter DNA-Viren, von denen mittlerweile mehr als 150 Genotypen bekannt sind. Sie werden hauptsächlich durch sexuelle Kontakte übertragen und infizieren Epithelien der Haut und verschiedener Schleimhäute. Spätestens seit 2008, als der Heidelberger Virologe Prof. Harald zur Hausen den Nobelpreis für Medizin erhielt, gehört es zum medizinischen Allgemeinwissen, dass die HPV-Hochrisikotypen (HR) 16 und 18 Gebärmutterhalskrebs auslösen können, und dass eine Impfung junger Mädchen vermutlich lebenslangen Schutz vor dieser Krebsart bietet.
Zum Allgemeinwissen gehört leider auch, dass in Deutschland eine gewisse Impfmüdigkeit oder sogar Skepsis herrscht: Die HPV-Impfrate liegt auch zehn Jahre nach der Entwicklung der ersten bivalenten Vakzine unter 50%; in Großbritannien und Australien sind es bis zu 80%.
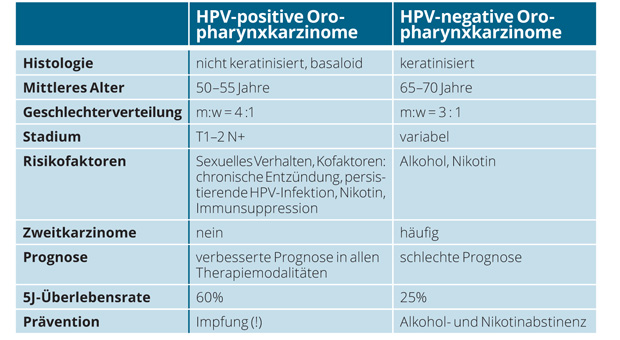
Was weit weniger bekannt ist: Seit 2003 verdichten sich die Hinweise, dass HPV-Hochrisikotypen auch Kopf-Hals-Tumoren verursachen können [1]. Mit über einer halben Million Fälle rangiert diese heterogene Gruppe von Tumorerkrankungen immerhin auf Platz 6 der weltweiten Häufigkeitsskala. Im HPV-Kontext ist vor allem das Mundhöhlenkarzinom (Oropharyngeal Cancer, OPC) mit einer Inzidenz von weltweit 200.000–350.000 Neuerkrankungen pro Jahr zu erwähnen, denn der Genotyp HR16 findet sich in mindestens 87% der HPV-positiven OPC [2] und ist damit offenbar deren Hauptverursacher (Tab. 1).
In den letzten vier Jahrzehnten nahm zwar – nicht zuletzt bedingt durch den Rückgang des Tabakkonsums – die Inzidenz der Kopf-Hals-Tumoren ab, doch speziell die Zahl der HPV-assoziierten OPC stieg gegenläufig an. Über 70% aller OPC in den USA und Westeuropa werden heute mit HPV assoziiert [3]; von den Betroffenen sind ca. 75% männlich.