Immer mehr zur Behandlung solider Tumoren zugelassene Wirkstoffe verlangen zwingend einen molekularpathologischen Biomarkertest, um die Wirksamkeit der gezielten Erstlinientherapie zu sichern oder bei Entwicklung von Resistenzmutationen einen Therapiewechsel zu initiieren.
Schlüsselwörter: Companion Diagnostics, Biomarker, Liquid Biopsy
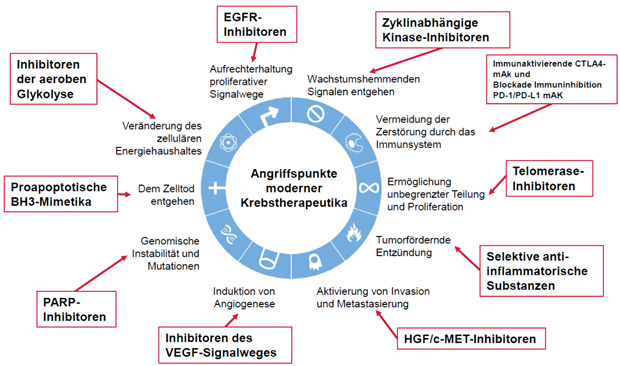
„Personalisierte Medizin“ ist eines der meistgenannten Schlagworte der Onkologie, denn Krebserkrankungen erfordern aufgrund ihrer molekularbiologischen Heterogenität in der Regel eine individuelle Therapie (Abb. 1). Für den Molekularpathologen bedeutet dies, dass zusätzlich zur herkömmlichen Untersuchung begleitende Analysen (Companion Diagnostics, CDx) wie beispielsweise die oben dargestellte PD-L1-Expression beim nicht-kleinzelligen Lungenkrebs (NSCLC) in die Empfehlungen an den Onkologen einbezogen werden müssen. Diese Tests dienen vor allem dazu, Untergruppen von Patienten zu bilden (Stratifikation), die mit einem spezifischen Medikament behandelt werden können. Einige Biomarker wie zum Beispiel die T790M-Mutation zeigen auch die Entwicklung von Resistenzen an, die eine Therapieumstellung erfordern.
In Deutschland sind im Rahmen der personalisierten Medizin derzeit 53 Arzneimittel zugelassen, für die in einer offiziellen Bekanntmachung oder Fachinformation eine molekularpathologische Testung vor der Behandlung zwingend erforderlich (n = 46) oder empfohlen (n = 7) wird. Die Onkologie nimmt mit 41 Wirkstoffen – davon 31 zur Behandlung solider Tumoren – den größten Raum ein (Tab. 1).