Schlüsselwörter: fäkaler Mikrobiota-Transfer, Clostridium-difficile-Infektionen, Stammzelltransplantation
Der menschliche Körper beherbergt auf seinen inneren und äußeren Oberflächen Milliarden von Mikroorganismen (die sog. Mikrobiota), die eine intensive wechselseitige Beziehung mit dem Wirt eingehen: Beispielsweise kann die intestinale Mikrobiota die Darmbarriere, den Stoffwechsel und das Immunsystem des Wirts entscheidend beeinflussen.
Kaum ein Bereich der biomedizinischen Forschung hat in den letzten Jahren so große Fortschritte zu verzeichnen. Dies beruht vor allem auf der rasanten methodischen Entwicklung im Bereich der Hochdurchsatz-Sequenzierung und der Bioinformatik, mit denen die Gesamtheit der in der Mikrobiota enthaltenen genetischen Information, das sog. Mikrobiom, erfasst und katalogisiert werden kann. Dabei zeigt sich, dass der größte Teil der Gensequenzen schwer oder überhaupt nicht kultivierbaren Mikroorganismen zuzuordnen ist, sodass sich der Mikrobiologie hier eine völlig neue Welt erschließt. Zahlreichen Studien zur Assoziation des humanen Mikrobioms mit unterschiedlichsten Krankheiten belegen die medizinische Bedeutung dieser Erkenntnisse. C.-difficile-Infektionen (CDI), chronisch entzündliche Darmerkrankungen (CED) und Kolonkarzinome gehören ebenso dazu wie Diabetes vom Typ 2, die allergische Diathese und sogar neurologisch-psychiatrische Syndrome. Die gezielte Modulation der menschlichen Mikrobiota gilt als vielversprechender Ansatzpunkt für die Prävention und Therapie dieser Erkrankungen, was diesem Forschungszweig derzeit enorme öffentliche Aufmerksamkeit beschert.
Historie der Stuhltransplantation
Ein wichtiger therapeutischer Ansatz ist der sogenannte fäkale Mikrobiota-Transfer (FMT), also die Übertragung von Stuhl eines gesunden Spenders auf einen erkrankten Empfänger. Ziel ist es, die physiologische Darmbesiedlung nach einer krankheitsbedingten Veränderung (Dysbiose) wiederherzustellen.
Die Verwendung von Stuhl zur Therapie von gastrointestinalen Erkrankungen ist keine Erfindung der modernen Medizin. In historischen Quellen lassen sich frühzeitige – zum Teil geradezu heroische – Hinweise für die medizinische Anwendung von Stuhlübertragungen beim Menschen finden. Bereits im 4. Jahrhundert beschrieb der chinesische Mediziner Ge Hong in seinem Lehrbuch für Notfallmedizin die orale Aufnahme von menschlichem Stuhl nach Lebensmittelvergiftung und schwerer Diarrhö. Im 16. Jahrhundert wurde diese Darreichungsform aus ästhetischen Gründen als „gelbe Suppe“ oder „goldener Sirup“ umschrieben.
Während des Afrikafeldzugs im zweiten Weltkrieg wurden deutsche Soldaten angeblich nach nomadischem Vorbild mit frischem Kameldung gegen Bakterienruhr behandelt. 1958 berichtete der amerikanische Chirurg Dr. Ben Eisenman erstmals in einer wissenschaftlichen Publikation über den fäkalen Mikrobiota-Transfer: Er setzte erfolgreich Stuhlproben zur Behandlung von Patienten ein, die nach Antibiotikatherapie pseudomembranöse Enterocolitiden entwickelt hatten. Dies war sehr wahrscheinlich eine der ersten FMT-Behandlungen von C.-difficile-Infektionen (CDI), die aktuell die wichtigste Indikation zur Stuhltransplantation darstellen.
Rezidivierende CDI
Clostridium difficile ist heutzutage der häufigste Erreger Antibiotika-assoziierter Durchfallerkrankungen. In den vergangenen Jahren war besonders eine steigende Inzidenz von CDI mit einer Mortalität von 1 bis 10% in der älteren Bevölkerung zu beobachten. Auch die Anzahl schwerer CDI-Verläufe mit toxischem Megakolon, Ileus und Perforation bis zur Entwicklung einer pseudomembranösen Kolitis nimmt weiter zu.
Medikamente der Wahl zur Behandlung von CDI sind je nach Schwere der Symptomatik Metronidazol, Vancomycin oder Fidaxomicin. Schwer therapierbare Rezidive – wahrscheinlich verursacht durch die Reaktivierung von umweltresistenten Endosporen – treten in 10 bis 25% der Fälle auf. Hier ist häufig eine antimikrobielle Intervalltherapie notwendig, und besonders schwere, therapierefraktäre Verläufe müssen sogar durch chirurgische Eingriffe behandelt werden.
Eine Antibiotikatherapie führt zur drastischen Reduktion der Mikrobiota, in deren Folge die Kolonisationsresistenz durch kommensale Darmbakterien massiv gestört und die Ausbreitung von Pathogenen begünstigt wird. Daher zeigen CDI-Patienten eine veränderte bakterielle Zusammensetzung des Gastrointestinaltrakts; allerdings scheint das Mikrobiom der Patienten vor FMT nicht prädiktiv für die Rückkehr der Infektion zu sein.
Die erste randomisierte klinische Studie zur Therapie von CDI durch FMT wurde in Amsterdam durchgeführt und 2013 veröffentlicht [1]. Den Patienten der Verum-Gruppe wurde nach viertägiger Vancomycin-Behandlung und Darmlavage mit Polyethylenglykol-Lösung die Stuhlsuspension eines gesunden Spenders mittels Nasoduodenalsonde verabreicht, während eine weitere Gruppe lediglich eine Standard-Vancomycin-Therapie über zwei Wochen erhielt. Die Studie ergab bereits nach einmaliger FMT-Applikation Erfolgsraten von 80 bis 90%, welche deutlich über dem Ansprechen in der Kontrollgruppe (31%) lagen. Inzwischen wurden vergleichbare randomisierte klinische Studien mehrfach wiederholt und zeigten ähnlich hohe Erfolgsraten.
Praktische Hinweise
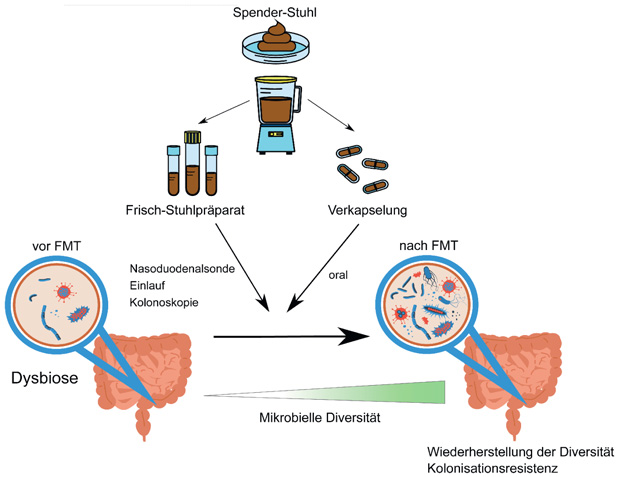
Zur Verabreichung der Stuhlsuspension sind mehrere Applikationswege möglich, wobei die Art jedoch offenbar einen relativ geringen Effekt auf die Wirksamkeit bei der Behandlung von CDI hat: Die Verabreichung über eine Duodenalsonde, per Rektaleinlauf oder von verkapselten FMT-Produkten ergaben jeweils ähnliche Erfolgsraten zwischen 70 und 90%.
Als Vorbereitung für die Applikation werden in jedem Fall zunächst etwa 30 bis 50 Gramm Stuhl in steriler Kochsalzlösung suspendiert und gemischt. Für das Mischen kommt häufig ein handelsüblicher Haushaltsmixer zum Einsatz; anschließend wird die Suspension zur Entfernung unverdauter Nahrungebestandteile und größerer Partikel filtriert.
Die Stuhlsuspension muss innerhalb von sechs Stunden verabreicht werden. Alternativ kann die resultierende klare Flüssigkeit nach Zugabe von Glycerin verkapselt und bei -80 °C kryokonserviert werden (Abb. 1). Die Verabreichung erfolgt dann oral.