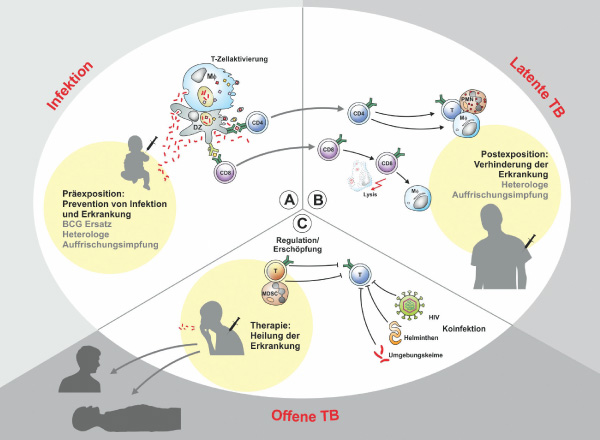
Bei einer Krankheit, die in den letzten 200 Jahren eine Milliarde Menschenleben gefordert hat und im Jahr 2015 auf fast 2 Millionen Todesopfer kam, denken wahrscheinlich nur wenige an Tuberkulose (TB) [1, 2]. Die Schwindsucht wird heute zu häufig vergessen, obwohl sie alles andere als besiegt ist. Jeder vierte Mensch auf unserem Erdball ist mit dem Erreger Mycobacterium tuberculosis (Mtb) infiziert. Gut zu wissen, dass von diesen rund 2 Milliarden Menschen nur wenige erkranken, denn unsere körpereigene Abwehr hält bei fast allen Infizierten den Krankheitserreger in Schach. Allerdings ist unser Immunsystem nicht in der Lage, die Infektion zu beenden, also den Keim abzutöten. Vielmehr überdauert der Erreger in einer Art „Winterschlaf“ und kann zu einem späteren Zeitpunkt „aufwachen“, um dann eine offene TB hervorzurufen. 2015 erkrankten mehr als 10 Millionen Menschen an offener TB. Besonders betroffen sind die 15 Millionen, die mit HIV (Humanes Immundefizienz-Virus) ko-infiziert sind. Da HIV die Immunantwort gegen die TB-Erreger schwächt, liegt das Risiko an TB zu erkranken mehr als zehnfach höher. Weiter erschwert wird die Situation durch die Zunahme an multiresistenten (MDR) und extensiv resistenten (XDR) TB-Fällen. Aufgrund der langen Behandlungsdauer und des komplizierten Schemas wird die Therapie häufig verfrüht abgebrochen. Knapp eine halbe Million aller TB-Patienten leidet derzeit an einer MDR-TB, von denen mehr als 120.000 sterben. Die TB ist somit nicht nur die tödlichste Infektionskrankheit überhaupt, sondern auch die häufigste Todesursache aufgrund der antimikrobiellen Resistenz (AMR) [1].
Inwieweit die Forderung der WHO (World Health Organization) unter diesen Umständen erfüllt werden kann, die Morbidität um 90% und die Mortalität um 95% zu reduzieren, bleibt ungewiss. Auf jeden Fall besteht Einigkeit, dass dringend bessere Medikamente, Diagnostika und Impfstoffe benötigt werden, um dieses Ziel zumindest annähernd zu erreichen. In diesem Beitrag werde ich der Frage nach einem besseren Impfstoff gegen TB nachgehen.
Geschichte
Als Robert Koch (1843–1910) am 24. März 1882 die Ätiologie der TB aufgeklärt hatte, war das nicht nur für Mediziner, sondern auch für die Allgemeinbevölkerung eine Sensation. TB stand nämlich damals an Nummer 1 aller Todesfälle [3]. Robert Koch gelang nicht nur der Nachweis des Erregers in TB-Patienten, sondern auch die Reinzucht des Erregers und die Auslösung der Krankheit durch angezüchtete Keime in Tiermodellen. 1890 berichtete Koch auch über erste Versuche zur Impfung: Er verwendete einen Erregerextrakt, mit dem er die TB nicht nur verhindern, sondern auch heilen wollte. Aus heutiger Sicht hatte er einen molekularen Ansatz gewählt, nämlich Spaltvakzine aus Protein-Antigenen und Glykolipid-Adjuvanzien. Koch erhoffte sich einen Präventiv- und Therapie-Impfstoff. Leider schlugen seine Versuche fehl und bereits 1891 stellte ein Bericht zur Wirksamkeit des Koch’schen Heilmittels gegen TB fest, dass die therapeutische Wirkung vernachlässigbar war. Nach diesem Befund kam es gar nicht mehr zu einer Studie über eine Präventiv-Impfung. Die Untersuchungen hatten aber etwas Gutes, denn sie zeigten, dass das eingesetzte Material zur Diagnostik einer TB-Infektion genutzt werden kann, auch wenn dabei nicht zwischen Erkrankung und Infektion unterschieden wird. Bis heute wird der sogenannte Tuberkulin-Hauttest zur Bestimmung einer Mtb-Infektion eingesetzt.
1906 versuchten die französischen Forscher Albert Calmette (1963–1933) und Camille Guérin (1872–1961) eine andere Strategie, nämlich einen attenuierten Lebendimpfstoff [4]. 1906 begannen sie mit der Passage von Mycobacterium bovis, dem Erreger der Rinder-TB, auf Kartoffelscheiben, die mit Ochsengalle getränkt waren. Alle 14 Tage wurden die Keime passagiert, und ab der 30. Passage immer wieder auf Schutz und Sicherheit überprüft.
Nach der 230. Passage im Jahr 1919 konnten sich die Forscher davon überzeugen, dass der Stamm in Experimentaltieren sicher war und schützte. 1921 wagten sie die erste Impfung eines Neugeborenen, das in einem Haushalt mit einer TB-Patientin geboren worden war. Obwohl das Risiko an TB zu erkranken bei 1 : 4 lag, erkrankte das Kind nicht. Ermutigt durch erste Einzelbefunde wurde eine groß angelegte Impfstudie mit über 20.000 Kleinkindern durchgeführt. Diese belegte, dass der BCG-Impfstoff bei Kleinkindern einen Schutz gegen die heftig verlaufende extrapulmonäre TB bewirkt.
Allerdings ist der Impfschutz gegen die häufigste Form der Krankheit, die Lungen-TB, bei allen Altersgruppen ungenügend [5]. Noch immer verstehen wir nicht vollständig, warum BCG gegen extrapulmonäre TB wirkt, aber nicht gegen die Lungen-TB. Ein Blick in die zugrunde liegenden Immunmechanismen bei der TB hilft zu einem besseren Verständnis.