Periprothetische Infektion: Herausforderung für Betroffene und Gesundheitssystem
DOI: https://doi.org/10.47184/td.2024.01.04Eine periprothetische Infektion ist die schwerwiegendste Komplikation in der Endoprothetik, denn es resultieren hieraus nicht selten langfristige Krankheitsverläufe, die sowohl Patient:innen als auch das Gesundheitssystem vor eine große Herausforderung stellen. Das bisher größte Problem liegt in der Diagnostik, da es keinen eindeutigen Parameter gibt, mit dem eine periprothetische Infektion sicher nachgewiesen bzw. ausgeschlossen werden kann. Dies kann zu Fehldiagnosen führen und verhindern, dass Patient:innen eine adäquate Therapie erhalten.
Schlüsselwörter: Totalendoprothese, TEP, PJI, MSIS, IDSA, ICM, EBJIS, Mikrobiologie, Sonikation
Nach Angaben des aktuellen Jahresberichtes des Endoprothesenregisters Deutschland (EPRD) werden in der BRD inzwischen über 300.000 endoprothetische Eingriffe pro Jahr durchgeführt (Tab. 1).
Tab. 1: Aus dem aktuellen Jahresbericht des EPRD sieht man im Verlauf der Jahre eine stetig steigende Anzahl an Endoprothesenimplantationen und auch von Folgeoperationen. Die Zahlen beinhalten Hüft- und Knie-TEP-Implantationen [2].
2018 | 2019 | 2020 | 2021 | 2022 | |
|---|---|---|---|---|---|
Primärversorgungen | 272.455 | 285.700 | 263.000 | 277.512 | 314.909 |
Folgeeingriffe | 31.271 | 33.457 | 32.057 | 32.654 | 32.793 |
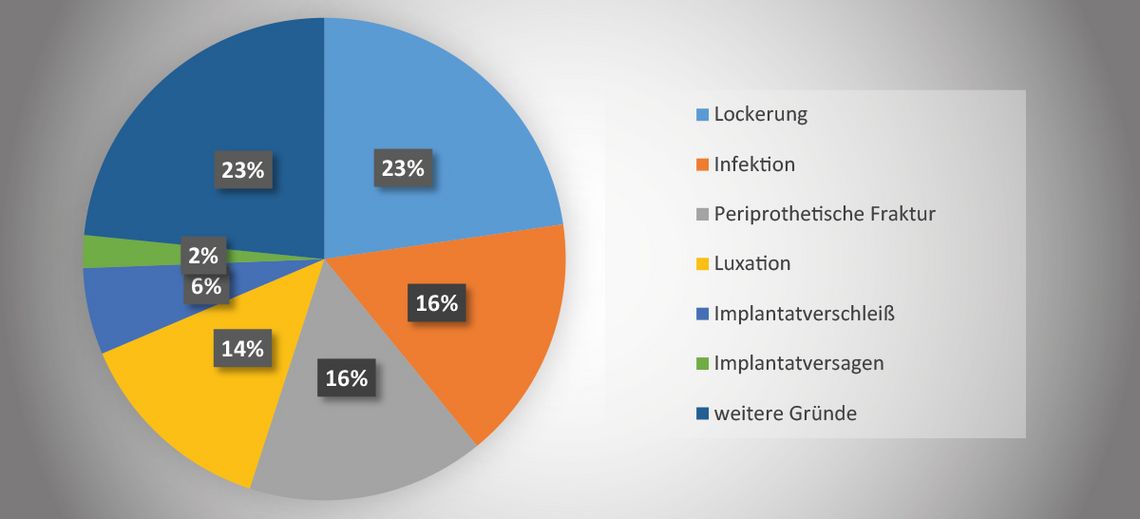
Infolge steigender Zahlen ist auch eine Zunahme von Revisionsoperationen zu erwarten [1]. Gemäß dem EPRD war im Jahre 2022 nach Primärimplantation einer Hüft-Totalendoprothese (TEP) die aseptische Lockerung (22,7 %) der häufigste Grund für eine Revisionsoperation, gefolgt von periprothetischer Infektion (Prosthetic Joint Infection, PJI) (16,4 %) und periprothetischen Frakturen (15,9 %) [2] (Abb. 1).
Die Inzidenz einer PJI beträgt in den ersten zwei Jahren nach Primärimplantation einer Hüft-TEP bzw. Schulter-TEP weniger als 1 %, einer Knie-TEP weniger als 2 % und einer Ellbogenprothese weniger als 9 % [3]. Sollte eine Revisionsoperation nach Hüft-TEP-Implantation nötig sein, so steigt die Inzidenz einer PJI schon auf bis zu 5 % [4–6]. Revisionen aufgrund einer PJI (am Beispiel Hüft-TEP) sind im Vergleich zu aseptischen Lockerungen und periprothetischen Frakturen nahezu doppelt so teuer [7, 8]. Darüber hinaus stellen Komplikationen nach Endoprotheseneingriffen für die meist älteren Patient:innen aufgrund der Konsequenzen eine erhebliche Belastung dar, sodass es essenziell ist, diese frühzeitig auszuschließen bzw. zu erkennen und adäquat zu therapieren.
Klassifikation und klinisches Erscheinungsbild
Die Klassifikation einer PJI erfolgt einerseits in Früh- und Spätinfekte, andererseits in akute und chronische Infekte (sog. low-grade Infekte).
Ein Frühinfekt liegt vor, wenn der Infekt in den ersten vier bis acht Wochen nach der Implantation der Endoprothese auftritt [9, 10]. Bei Spätinfekten gibt es unterschiedliche Zeitangaben in der Literatur. Schafroth et al. beschreiben einen Spätinfekt ab zwei Jahren postoperativ, die Zeit zwischen Früh- und Spätinfekt wird hier als verzögerter Infekt definiert [9]. Die Arbeitsgruppe um Widmer et al. [10] hat eine abweichende Einteilung erarbeitet: Es wird nur in Früh- und Spätinfekte unterschieden; von einem Spätinfekt wird schon ab vier Wochen nach der Operation gesprochen. Therapeutisch aussagekräftiger und einheitlicher ist zweitere Einteilung [11].
Eine akute PJI präsentiert sich mit den typischen lokalen (rubor, dolor, calor, tumor, functio laesa) und meist auch systemischen Infektzeichen (Fieber, Allgemeinzustandsverschlechterung, Schüttelfrost, ggf. Sepsis). Diese Art von Infektion tritt entweder direkt postoperativ durch intraoperative Kontamination des OP-Gebietes oder durch hämatogene Streuung auf. Prinzipiell können alle Infektionen im Körper durch hämatogene Streuung eine PJI verursachen; am häufigsten sind hier kardiovaskuläre Infektionen, Infektionen im HNO-Bereich, Infektionen der Zähne und des Urogenitaltraktes der Auslöser [12].
Chronische bzw. low-grade Infekte stellen in der Klinik eine größere Herausforderung dar, da diese oftmals unspezifische Symptome verursachen. Meist berichten Betroffene über Beschwerden im Bereich des Gelenkes, radiologisch zeigt sich eine Prothesenlockerung, aber Zeichen einer akuten Infektion liegen hier nicht vor [11]. Bei unzureichender Erfahrung der behandelnden Mediziner:innen können hier leicht Fehldiagnosen entstehen.
Eine chronische Infektion liegt vor, wenn das Intervall zwischen Symptom- und Therapiebeginn mehr als zwei bis vier Wochen beträgt [13–15]. In dieser Zeit haben die Bakterien (z. B. koagulasenegative Staphylokokken, Proprionibakterien) einen reifen Biofilm ausgebildet, die Antibiotika können diesen nicht mehr durchbrechen und ein Prothesenerhalt ist dann nicht mehr möglich. Ein Biofilm ist eine Ansammlung von Mikroorganismen an Oberflächen (sowohl körpereigene als auch – häufiger – Fremdimplantate) von extrazellulären polymeren Substanzen, die hauptsächlich aus Polysacchariden, Proteinen und DNA besteht [16].
Diagnostik
Der Weg zur Diagnosesicherung und die Kriterien einer PJI sind bisher nicht einheitlich festgelegt. International sind vor allem die Diagnosekriterien folgender Fachgesellschaften anerkannt: MSIS (Musculoskeletal Infection Society) [17], IDSA (Infectious Diseases Society of America) [13], ICM (International Consensus Meeting) [18] oder EBJIS (European Bone and Joint Infection Society) [19] (Tab. 2).
Tab. 2: Grenzwerte zur Diagnose einer PJI (modifiziert nach [19]).
PJI unwahrscheinlich(alle Kriterien erfüllt) | PJI wahrscheinlich(≥ 2 Kriterien erfüllt) | PJI bestätigt(≥ 1 Kriterium erfüllt) | |
|---|---|---|---|
Punktion | Zellzahl < 1.500/μl Granulozytenanteil < 65 % Langzeitbebrütung negativ | Zellzahl > 1.500/μl Granulozytenanteil > 65 % Keimnachweis in der Langzeitbebrütung | Zellzahl > 3.000/μl Granulozytenanteil > 80 % Keimnachweis in der Langzeitbebrütung |
Mikrobiologie | negativ | Keimnachweis in 1 Probe | Nachweis des identischen Keimes in ≥ 2 Proben |
Histologie | negativ | ≥ 5 Neutrophile in 1 GF (Gesichtsfeld) | ≥ 5 Neutrophile in ≥ 5 GF, sichtbare Erreger |
Sonikation | negativ | 1–50 KBE/ml | > 50 KBE/ml |
Klinik | Implantatdysfunktion sicher anderweitig erklärbar | Lockerungszeichen Wundheilungsstörung CRP > 10 mg/l Fieber/Bakteriämie Putrider Verhalt um die Prothese | Fistel |
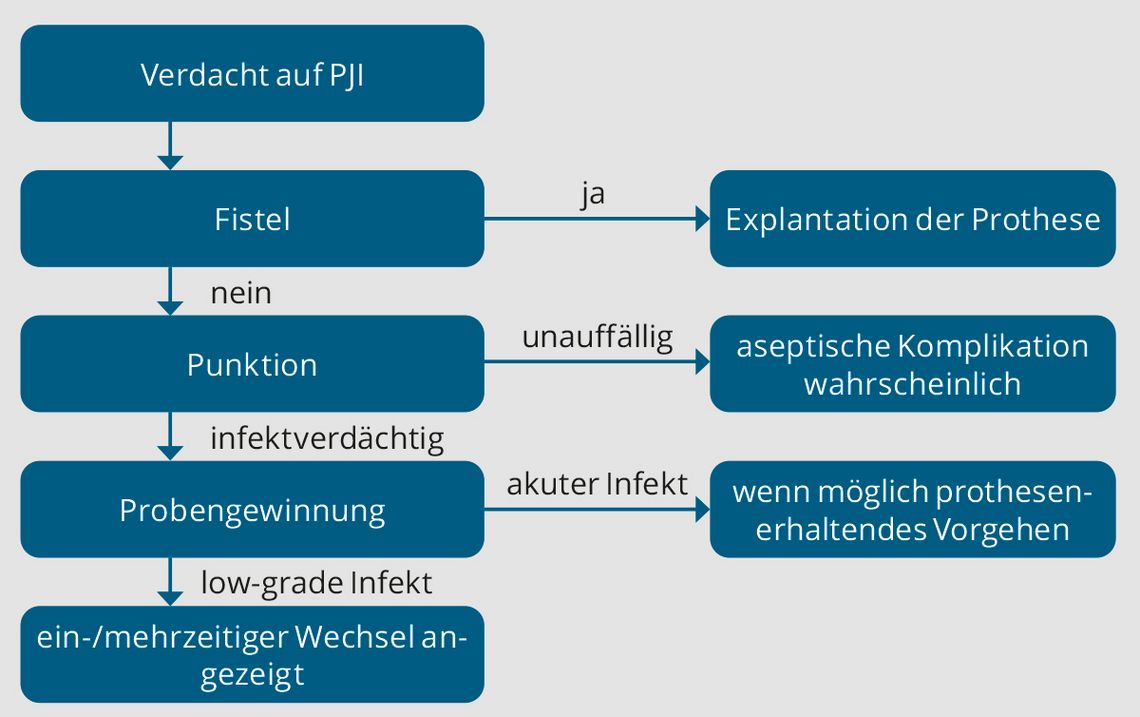
In Anlehnung an die genannten Leitlinien erarbeitete die Arbeitsgemeinschaft Endoprothetik (AE) einen Diagnostikalgorithmus [11] (Abb. 2).
Bei begründetem Verdacht auf eine PJI sollte eine Punktion des Gelenkes erfolgen. Die Synovialflüssigkeit wird zur zytologischen und mikrobiologischen Untersuchung eingeschickt. Es wird eine Bebrütung von 14 Tagen empfohlen. Ein Problem bei der Gelenkpunktion ist der relativ hohe Anteil von falsch positiven Ergebnissen. In der Literatur wird dieser mit 7–11 % angegeben [11]. Besteht nach Auswertung des Punktionsergebnisses und klinisch weiterhin der hochgradige Verdacht auf eine PJI, so muss eine entsprechende chirurgische Intervention durchgeführt werden. Intraoperativ sollten ca. drei bis sechs Bioptate, am besten aus dem Interface zwischen Gewebe und Prothese entnommen und anschließend umgehend mikrobiologisch und histologisch ausgewertet werden [13, 22].
Ist eine Prothesenexplantation angezeigt, so kann das Explantat zusätzlich zur Sonikation eingeschickt werden. Die Sonikation ist ein Diagnostik-Tool, bei dem mittels Ultraschallbad Bakterien vom Explantat gelöst und anschließend bebrütet werden. Sonikation bringt in der Diagnostik der low-grade Infekte und bei antibiotisch anbehandelten Patient:innen möglicherweise aufgrund ihrer höheren Sensitivität einen Mehrwert [20]. Besteht eine Fistel mit Kontakt zum Gelenk ist dies ein sicheres klinisches Zeichen einer PJI.
Therapie
Die Therapie einer PJI ist eine Kombination aus chirurgischer Intervention und antibiotischer Therapie. Bei einem Symptombeginn innerhalb von weniger als vier Wochen, guter Weichteildeckung und radiologisch nicht gelockerter, intakter TEP kann ein prothesenerhaltender Therapieversuch durchgeführt werden. Im Rahmen einer Operation erfolgt das ausgiebige Debridement, Probengewinnung und der Wechsel der mobilen Teile (Inlay, Kopf). Eine kalkulierte antibiotische Therapie sollte direkt nach Probengewinnung intraoperativ erfolgen. Nach Erhalt des Resistogrammes kann eine Deeskalation im Verlauf durchgeführt werden. Zusätzlich sollten hier je nach Keimspektrum ein biofilmaktives Antibiotikum (z. B. Rifampicin, Fosfomycin) verabreicht werden. Die Dauer der Antibiotikatherapie ist meist auf drei Monate festgesetzt, davon zwei Wochen postoperativ intravenös, anschließend Oralisierung auf ein gut knochengängiges Präparat für ca. zehn Wochen [13, 21, 22].
Ist ein Prothesenerhalt nicht möglich (z. B. radiologische Lockerungszeichen, Pilzbefall, multiresistenter Erreger, schlechte/fehlende Weichteildeckung, Fistel zum Gelenk), muss eine mehrzeitige Wechselstrategie durchgeführt werden. In einer Revisionsoperation erfolgt ein Debridement und die Explantation der Prothese. Im Bereich der Hüfte kann bis zur Reimplantation eine Girdlestonesituation (Gelenk ohne Spacer) belassen werden, am Kniegelenk erfolgt meist die Anlage einer temporären Arthrodese. Es erfolgt wiederum eine intravenöse Antibiose. Eine Reimplantation sollte unter laufender Antibiose ca. sechs Wochen nach Explantation geplant werden, sofern dies in Bezug auf die Weichteile und den Allgemeinzustand möglich ist. Nach Reimplantation ist eine antibiotische Therapie mit biofilmaktiver Substanz durchzuführen [13, 21, 22].
Die antibiotische Therapie wird bei Infekten an der Hüfte (ab Explantation) für insgesamt zwölf Wochen empfohlen, bei Knie-TEP-Infekten (ab Explantation) bis zu sechs Monaten. Perioperativ sollte die Antibiotikagabe für zwei bis vier Wochen intravenös gegeben werden, anschließend ist eine Oralisierung auf ein gut knochengängiges Präparat mit hoher Bioverfügbarkeit möglich [13, 21, 22].
Kann der Infekt trotz mehrfacher chirurgischer Revisionen und Antibiotikatherapie nicht eradiziert werden, ist eine dauerhafte Arthrodese des entsprechenden Gelenkes bzw. eine Girdlestonesituation anzulegen; im schlimmsten Fall ist sogar eine Amputation der Gliedmaße nötig [21, 22].
Fazit
Die Diagnostik einer PJI ist und bleibt eine Herausforderung für die Orthopädie. Einen einzelnen Diagnostikparameter gibt es bis dato noch nicht, sodass Fehldiagnosen nicht auszuschließen sind. Es sind weitere Studien nötig, um möglichst einen Parameter mit hoher Sensitivität und Spezifität zu identifizieren.