Kynurenin: Stoffwechselprodukt mit Potenzial
DOI: https://doi.org/10.47184/td.2024.01.03Der Kynurenin-Stoffwechselweg und seine Intermediate erfahren in den letzten Jahren zunehmend Aufmerksamkeit aus unterschiedlichsten Fachrichtungen. Im Folgenden werden wichtige grundlegende (patho-)physiologische Aspekte und einige Ausblicke für mögliche zukünftige diagnostische und therapeutische Anwendungen dargestellt.
Schlüsselwörter: Tryptophan, TDO, IDO, Immunsystem, Tumor, Neurobiologie, Analytik
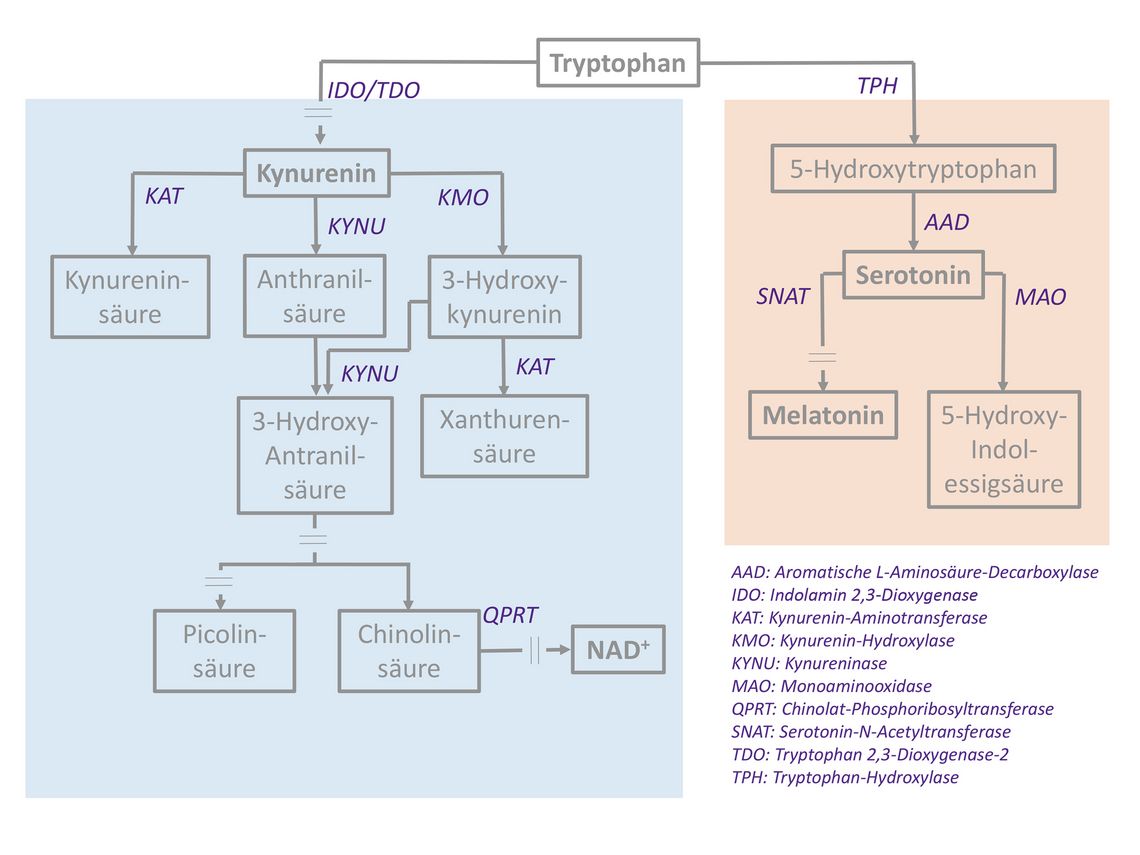
L-Kynurenin (der Name leitet sich aus dem erstmaligen Nachweis dieser Aminosäure im Urin von Hunden ab) ist ein Stoffwechselprodukt der essenziellen Aminosäure L-Tryptophan. In den klassischen Biochemielehrbüchern wird Kynurenin lediglich als Zwischenprodukt der NAD+ (Nikotinamidadenindinukleotid)-Synthese aus L-Tryptophan dargestellt. Das für den ersten Schritt des Tryptophanabbaus zuständige Schlüsselenzym ist die Tryptophan 2,3-Dioxygenase 2 (TDO2, kurz TDO). Die Verfügbarkeit von NAD+ ist unentbehrlich für grundlegende biochemische Funktionen wie die Atmungskette und den Citratzyklus.
Aus älteren Mikrobiologielehrbüchern ist eine weitere Funktion der Synthese von Kynurenin aus Tryptophan bekannt: Nach Infektion mit Toxoplasma gondii werden betroffene Areale durch massiv induzierte Enzymaktivität Tryptophan-depletiert, sodass aufgrund des Mangelzustands die Toxoplasmen zu ihrer „Ruheform“, den Bradyzoiten, gezwungen werden. Infolge des massiv gesteigerten Tryptophanabbaus entstehen lokal hohe Konzentrationen des Produkts Kynurenin. Hierbei ist die Indolamin 2,3-Dioxygenase 1 (IDO1, kurz IDO) das für den ersten Schritt des Tryptophanabbaus zuständige Schlüsselenzym (Abb. 1).
Anhand dieser beiden Beispiele aus der (Patho-)Physiologie erkennt man, dass im humanen Organismus zwei Schlüsselenzyme für die Synthese des Kynurenin aus Tryptophan, TDO und IDO zur Verfügung stehen. TDO und IDO unterscheiden sich dabei bezüglich Substratspezifität, Expression in verschiedenen Geweben und Induzierbarkeit: Die TDO ist streng spezifisch für L-Tryptophan und wird vorwiegend in Hepatozyten exprimiert, wobei die Expression relativ stabil ist. Die Enzymaktivität der TDO wird vorwiegend über die Substratverfügbarkeit reguliert, aber auch über Glukokortikoide induziert. Die IDO hingegen ist nicht Tryptophan-spezifisch, sondern degradiert alle Indolamine (Tryptophan ist durch seinen Indolamin-Ring charakterisiert; weitere prominente Beispiele für Indolamine sind der Neurotransmitter Serotonin und das Neurohormon Melatonin); die IDO wird in unterschiedlichsten Zellen und Geweben wie Monozyten/Makrophagen/Mikroglia, Endothelzellen, Trophoblasten und Tumorzellen exprimiert. Dabei unterliegen sowohl die Expression als auch die Enzymaktivität der Induktion insbesondere durch proinflammatorische Zytokine (allen voran IFNγ), aber auch durch Zytokin-unabhängige Mechanismen wie Aktivierung des TLR4. Vice versa inhibieren antiinflammatorische Zytokine (z. B. IL-4) die IDO.
Erworbene Immuntoleranz
Aus der erweiterten Substratspezifität der IDO und ihrer Kontrolle durch Immunbotenstoffe ergibt sich ein relativ weites Feld an physiologischen und pathophysiologischen Mechanismen, an denen dieses Enzym beteiligt ist. Eine herausragende und maßgebliche Studie zur Rolle der IDO publizierte das Team um Andrew Mellor und David Munn 1998: Sie untersuchten das bis dato ungeklärte Phänomen, dass fötales Gewebe, welches zu 50 % körperfremd ist, nicht vom maternalen Immunsystem als fremd erkannt und damit abgestoßen wird [1]. Mellor und Munn injizierten trächtigen Mäusen einen IDO-Inhibitor und lösten damit eine massive Immunreaktion des maternalen Organismus gegen das fötale Gewebe aus, sodass es zur Abstoßung kam. Damit zeigten sie, dass der IDO-vermittelte Tryptophanabbau zu Kynurenin eine entscheidende Rolle in der Kontrolle der erworbenen Immuntoleranz spielt.
Transplantatabstoßung
Nicht nur die IDO unterliegt in Expression und Aktivität der Regulation durch Zytokine. Auch das Enzym KMO, das im nächsten Schritt Kynurenin zu 3-Hydroxykynurenin (3-HK) modifiziert, wird in derselben Weise über Zytokine reguliert. Dementsprechend weisen aktuelle Daten darauf hin, dass die Blutkonzentrationen von 3-HK und die Ratio 3-HK/Kynurenin als frühe Biomarker für eine drohende Transplantatabstoßung dienen könnten [2].
Depression
Die erweiterte Substratspezifität der IDO weckte auch sehr früh das Interesse der neurobiochemischen Forschung an einem möglichen Zusammenhang zwischen proinflammatorischen Signalen und der verstärkten Degradation des Neurotransmitters Serotonin. Das als „sickness behaviour“ bezeichnete Phänomen beschreibt die im Rahmen einer systemischen Inflammation auftretende Verhaltensänderung, die einer depressiven Erkrankung ähnelt. Dieses Phänomen war jahrelang auf neurochemischer Ebene nicht zu erklären. Durch den direkten Einfluss proinflammatorischer Zytokine auf die IDO-Aktivität und die damit einhergehende zentralnervöse Degradation von Serotonin (und auch Melatonin) konnte endlich ein direkter funktionaler Link hergestellt werden. Der „proof of principle“ dieser neurobiochemischen Hypothese für eine Subgruppe der Depression wurde letztlich in kontrollierten klinischen Studien überprüft, in denen unter Depression leidende Menschen mit antiinflammatorischen Arzneistoffen behandelt wurden [3]. Dabei scheint das Verhältnis von Kynurenin zu Tryptophan als Marker für die Enzymaktivität ein potenzieller Prädiktor für Ansprechen auf die antiinflammatorische Therapie zu sein.
Schizophrenie und Alzheimer
Zwei weitere Beispiele für die neurochemische Relevanz des Kynurenin-Stoffwechsels mit seinen Intermediaten beziehen sich auf die Schizophrenie und die Alzheimer-Demenz: Die Gruppe um den Pharmakologen Robert Schwarcz zeigte, dass die Kynureninsäure, ein alternatives Stoffwechselprodukt des Kynurenin, ein Rezeptorantagonist der Neurotransmitter Glutamat (insbesondere am NMDA-R, mit geringerer Affinität an den beiden anderen ionotropen Glutamatrezeptoren Kainat-R und AMPA-R) und Azetylcholin (am a7nACh-R) ist. Die Glutamathypothese der Schizophrenie, die durch die Dopamin-Hypothese eher in den Hintergrund gedrängt worden war, gewann damit an neuer Bedeutung insbesondere für die kognitiven Symptome der Schizophrenie [4].
Im Rahmen der Pathophysiologie der Alzheimer-Demenz wird einem weiteren Metaboliten des Kynurenin eine wichtige Rolle zugeschrieben: der Chinolinsäure (engl. quinolinic acid), die im Gegensatz zur Kynureninsäure ein Agonist des NMDA-Rezeptors ist und in höheren Konzentrationen durch übermäßige glutamaterge Neurotransmission zur sogenannten Exzitotoxizität führen kann. Kurzgefasst scheint die Mikrogliaaktivierung, die bereits Alois Alzheimer neben den intrazellulären Bündeln (hyperphosphoryliertes Tau-Protein) und den extrazellulären Plaques (aggregiertes β-Amyloid) als drittes pathomorphologisches Merkmal der Alzheimer-Demenz beschrieb, zu einer lokalen Induktion von IDO und KMO zu führen. In der Folge entsteht chronisch vermehrt Chinolinsäure. Dies resultiert neben der genannten Exzitotoxizität mit Membranschädigung u. a. auch in einem gesteigerten Kalzium-Influx und einer verminderten Expression spezifischer Proteinphosphatasen, sodass es zu einer verstärken Phosphorylierung des Tau-Proteins kommt [5]. Inwieweit diese Mechanismen von diagnostischer und evtl. therapeutischer Bedeutung sind, ist aktuell nicht abzuschätzen.
Immunfunktion
Die bisher beschriebenen Effekte beziehen sich auf die Modulation des Kynurenin-Stoffwechsels durch Immunbotenstoffe und auf neurobiochemische Effekte. Umgekehrt nehmen Intermediate des Kynurenin-Stoffwechsels aber auch Einfluss auf die Immunfunktion. So sind sowohl Kynurenin als auch die Kynureninsäure Liganden des Aryl-Hydrocarbon-Rezeptors (AHR), der u. a. eine wichtige antiinflammatorische Funktion hat. Ein weiterer Mechanismus, über den insbesondere die Kynureninsäure die Immunfunktion moduliert, bezieht sich auf GPR35 (G protein-coupled receptor 35), wodurch die Produktion von TNF und die Funktion von NF-κB, ERK, p38 reduziert werden. Insgesamt wird durch diesen Teil des Kynurenin-Stoffwechsels ein antiinflammatorischer Effekt ausgelöst, der mit der Induktion regulatorischer T-Zellen und der Inhibition zytotoxischer T-Zellen und NK-Zellen einhergeht.
Tumorbiologie
Die oben erwähnte Arbeit von Mellor und Munn zur Kontrolle der erworbenen Immuntoleranz initiierte die Erforschung des Kynurenin-Stoffwechsels in der Tumorbiologie. Tumorzellen exprimieren IDO und diese Expression scheint eine wichtige Rolle sowohl in der Vaskularisierung als auch der Metastasierung zu spielen. Da tumorinfiltrierende T-Zellen mit IFNγ einen wichtigen Induktor der IDO ausschütten, scheint dieser Mechanismus einen sehr unglücklichen Effekt auf Immun-Escape-Strategien der Tumorzellen zu haben [6]. Gleichzeitig besteht ein wichtiger Escape-Mechanismus in der über IDO-Aktivierung induzierten lokalen Tryptophan-Depletion, die in einer Hemmung der lokalen T-Zellantwort resultiert. Dementsprechend zielen pharmakologische Ansätze auf die Inhibition der IDO zur Kontrollierung des Immun-Escapes von Tumoren ab. Erste Ergebnisse klinischer Phase-I- und -II-Studien sind zeitnah zu erwarten [7].
Aufgrund der engen funktionellen Verzahnung zwischen Immunsystem und Kynurenin-Stoffwechsel gibt es zahlreiche weitere Erkrankungen, bei denen eine Beteiligung dieses Stoffwechsels in der Pathophysiologie erforscht wird: von Rheumatoider Arthritis über Atherosklerose bis hin zu Morbus Huntington [8].
Analytik
Methodisch ist die Analyse der Intermediate des Kynurenin-Stoffwechsels eine Herausforderung. Die Verwendung chromatografischer Methoden, insbesondere der Tandem-Massenspektrometrie, sind nicht nur der Goldstandard, sondern für eine differenzierte Analytik essenziell. Seitdem kommerzielle ELISAs zur Quantifizierung von Tryptophan und Kynurenin zur Verfügung stehen, werden bisweilen Labormethoden zur Darstellung der „IDO-Aktivität“ angeboten. Gerne wird dabei auf die oben beschriebenen Mechanismen verwiesen, ohne jedoch darauf einzugehen, dass die in der Leber exprimierte TDO einen quantitativ beträchtlichen Anteil an der Kynureninsynthese hat und somit das Verhältnis von Kynurenin zu Tryptophan nicht spezifisch die IDO-Aktivität widerspiegeln kann. Die validierte Einführung der Analyse von Kynurenin und/oder dessen Stoffwechselproduktion werden wir womöglich in den kommenden Jahren erleben. Eine vielversprechende Anwendung könnte das Post-Transplantationsmonitoring sein.
Fazit
Zusammenfassend bietet der Kynurenin-Stoffwechsel zahlreiche hochinteressante physiologische, pathophysiologische und potenziell therapeutische Aspekte. Die Datenlage ist aber aktuell noch nicht ausreichend solide, um Konzentrationsbestimmungen von Tryptophan, Kynurenin und dessen Metaboliten als Biomarker in der Diagnostik oder Prognostik einzusetzen.