Sonderpublikation
QIAsymphony® PAXgene Blood ccfDNA-Röhrchen und -Kit
Stabilisierung von Proben für die Liquid Biopsy
Die Liquid Biopsy, ein Verfahren zur Analyse zellfreier DNA aus dem Blut, etabliert sich zunehmend als minimal-invasive Methode zur Beurteilung von Krankheitsrisiken oder zur Verlaufskontrolle von Erkrankungen. Eine der Grundvoraussetzungen, um aussagekräftige Ergebnisse zu erhalten, sind schonende Lagerung und Transport der Proben
Einleitung
Zirkulierende, zellfreie DNA unterliegt in vitro sofort der Degradation. Zusätzlich wird aus den Leukozyten nach Apoptose genomische DNA und aus den Erythrozyten Hämoglobin freigesetzt. Beides stört die Detektion und Quantifizierung der ccfDNA.
Ein Transportmedium, in dem das verhindert wird, ist daher unabdingbar. Deshalb hat PreAnalytiX das PAXgene® Blood ccfDNA-System entwickelt, bestehend aus einem Blutentnahmeröhrchen (PAXgene Blood ccfDNA-Röhrchen) und einem Testkit für die automatisierte ccfDNA-Extraktion von bis zu 5 ml Plasma (QIAsymphony® PAXgene Blood ccfDNA-Kit). Das Blutentnahmeröhrchen besteht aus einem einzigartigen, nicht vernetzten Kunststoff, der die zellfreie DNA und die Blutzellen stabilisiert. In dieser Präsentation stellen wir die Ergebnisse der ccfDNA-Tests mit dem neuen System im Vergleich zu Vollblutproben vor, die in BD Vacutainer® K2EDTA-Röhrchen und Streck Cell-Free DNA BCT®-Röhrchen entnommen wurden.
Workflow des PAXgene Blood ccfDNA-Systems

Die Stabilisierung von Blutzellen verhindert die Apoptose
Das Vollblut von zwei Probanden wurde in EDTA-Blutentnahmeröhrchen entnommen und entweder in diesen bei Raumtemperatur gelagert oder direkt in Röhrchen mit PAXgene Blood ccfDNA-Stabilisierungsreagenz (PAX ccfDNA) überführt.
Versuchsbedingen:
t0 = sofortige Verarbeitung, t10 = Lagerung 10 Tage lang bei Raumtemperatur. Aus jeweils 200 µl des gelagerten Vollbluts erfolgte zuerst die Extraktion der genomischen DNA mit dem QIAamp Blood Mini Kit und aus 400 ng dieser DNA dann mittels Agarose-Gelelektrophorese die Trennung.
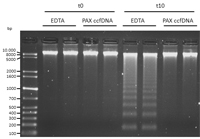
Fazit 1: Die im EDTA-Blutentnahmeröhrchen gelagerte Blutprobe zeigt deutliche Zeichen der Apoptose (t10 EDTA), während die Blutprobe im PAX ccfDNA-Röhrchen noch keine Zeichen von Apoptose aufwies (t10, PAX ccfDNA).
Hämolyse bei Transport und Lagerung
Das Vollblut von acht Probanden wurde in EDTA-Röhrchen entnommen und entweder in diesen auch gelagert oder direkt in Röhrchen mit PAXgene Blood ccfDNA-Stabilisierungsreagenz (PAX ccfDNA) überführt.
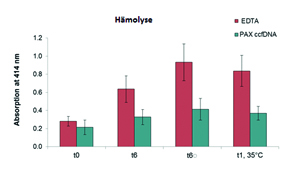
Versuchsbedingungen: t0 = Verarbeitung sofort nach der Entnahme; t6 = Lagerung 6 Tage lang bei Raumtemperatur, liegend; t6 = 5 Stunden lang kontinuierliches Schwenken zur Simulation von Transportbedingungen, dann Lagerung liegend für 6 Tage bei Raumtemperatur; t1, 35 ºC =Lagerung für einen Tag bei 35 ºC. Die Bestimmung der Hämolyse erfolgte anschließend aus dem Blutplasma, indem die Extinktion des freien Hämoglobins bei 414 nm gemessen wurde. Die Abbildung zeigt die mittlere Extinktion des Plasmas der 8 Probanden mit Standardabweichung.
ccfDNA-Stabilisierung bei Transport und Lagerung
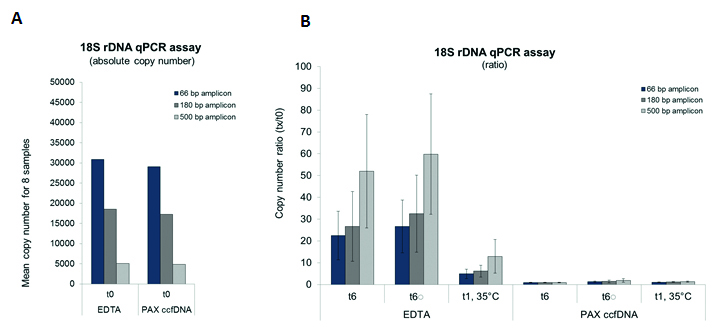
Das Vollblut von 8 Probanden wurde in EDTA-Blutentnahmeröhrchen entnommen, anschließend entweder gelagert oder direkt in Röhrchen mit PAXgene Blood ccfDNA-Stabilisierungsreagenz (PAX ccfDNA) überführt.
Versuchsbedingungen: t1, 35 ºC = Lagerung für einen Tag bei 35 ºC, t6 = Lagerung 6 Tage lang bei Raumtemperatur, t6 = 5 Stunden lang kontinuierliches Schwenken (Simulation der Transportbedingungen), anschließend Lagerung für 6 Tage liegend bei Raumtemperatur.
Die ccfDNA wurde nach dem PAXgene Blood ccfDNA QIAsymphony-Protokoll aus 2,4 ml Plasma extrahiert und die ccfDNA-Ausbeute mittels Echtzeit-PCR (18S-rDNA-Gen, Amplifikat mit 66 bp/180 bp/500 bp) quantitativ bestimmt. Die Abbildung links unten zeigt die Gesamtkopienzahl am Tag der Blutentnahme (A) und das Verhältnis der Kopienzahl tx/t0 zu den o. g. Versuchsbedingen (B).
Fazit 3: Das mit PAXgene Blood ccfDNA-Stabilisierungsreagenz stabilisierte Blut kann 6 Tage lang bei Raumtemperatur oder 1 Tag lang bei 35 ºC transportiert und gelagert werden, ohne dass es zu einem Anstieg der ccfDNA-Konzentration kommt. Die ccfDNA lässt sich effizient aus dem Plasma von stabilisiertem Blut extrahieren. Diese Ergebnisse sind mit denen von Plasma aus EDTA-Blut vergleichbar, das sofort nach der Blutentnahme verarbeitet wird.
NIPT aus stabilisiertem mütterlichem Blut
Vollblutproben von schwangeren Frauen wurden in beide Röhrchentypen entnommen und zu LifeCodexx transportiert. Dort erfolgte die Extraktion von ccfDNA mit dem QIAamp Circulating Nucleic Acid Kit.
A Bestimmung der zirkulierenden fetalen DNA und des fetalen Geschlechts der 18 Proben mit dem QuantYfeX®-Test.
B Präparation einer Genbibliothek und Hochdurchsatz-Sequenzierung (Illumina) aus den Eluaten der Genbibliothek. Die Gesamtanzahl der im Rahmen der Hochdurchsatz-Sequenzierung abgelesenen Sequenzabschnitte (Reads) wurde mit der PrenaTest® DAP.plus-Software prozentual in zugeordnete Reads und eindeutig zugeordnete Reads klassifiziert, um die Chromosomenaberrationen zu bestimmen (n = 18).
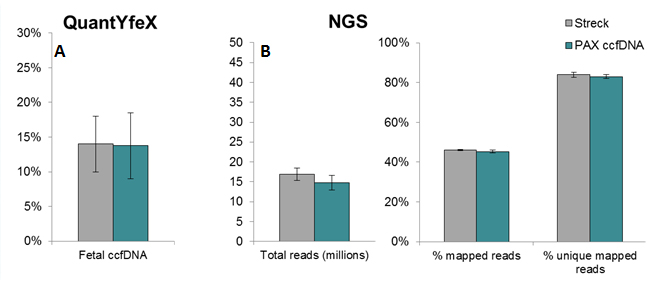
Fazit 4: Alle in PAXgene Blood ccfDNA-Prototypröhrchen entnommenen Proben erfüllten das Qualitätskriterium „Fetale Fraktion > 4%". Die absolute Ausbeute des fetalen ccfDNA war vergleichbar mit der aktuellen Methode und das fetale Geschlecht stimmte für die Entnahmeröhrchen aller Proben überein. Die Ergebnisse sämtlicher 18 Proben, die in PAXgene Blood ccfDNA-Röhrchen gelagert und dann mittels Hochdurchsatz-Sequenzierung und der PrenaTest DAP.plus-Software analysiert wurden, waren ebenfalls mit den Ergebnissen der aktuellen Methode gut vergleichbar; für die Trisomien 13, 18 und 21 fielen sie negativ aus.
Der vorgestellte Workflow inklusive der präanalytischen Stabilisierung der Blutproben ist somit bestens für die minimal-invasive Analyse von ccfDNA geeignet.
Dr. Wera Hofmann, LifeCodexx, Konstanz
w.hofmann[at]lifecodexx[dot]com

Dr. Antje Plaschke-Schlütter
0041 79 832 48 83
antje.plaschke-schluetter[at]qiagen[dot]com