Die Therapie der akuten lymphatischen Leukämie wurde in den letzten Jahrzehnten maßgeblich durch die Arbeit großer multizentrischer Studiengruppen wie der Deutschen Multizentrischen Studiengruppe für die akute lymphatische Leukämie des Erwachsenen (GMALL) oder im pädiatrischen Bereich der Gesellschaft für Pädiatrische Onkologie und Hämatologie (GPOH) vorangetrieben. Die pädiatrischen Kollegen waren bisher erfolgreicher, was die Heilungsraten angeht, aber auch bei den erwachsenen Patienten verheißen neue Medikamente und ausgefeiltere Strategien zur Therapiesteuerung für die Zukunft weitere Fortschritte – eine Auswahl von Studien zu diesen Themen, die bei der Jahrestagung der American Society of Hematology (ASH) im Dezember 2017 in Atlanta präsentiert wurden.
ALL bei Erwachsenen
Der Status bezüglich der minimalen Resterkrankung (MRD) unter Chemotherapie, d. h. das Verschwinden der malignen Zellen unter die Nachweisgrenze, gilt als wichtigster prognostischer Faktor bei der ALL. Verglichen mit Patienten, die eine molekulare Komplettremission erreichen, haben diejenigen mit molekularem Therapieversagen geringere Überlebenschancen und eine kürzere Remissionsdauer, und selbst nach allogener Stammzelltransplantation ist ihre Prognose schlechter [1]. Wie es Patienten ergeht, die außerhalb dieser Kategorien (MRD-negativ oder -positiv) fallen, ist ebenso wenig im Detail bekannt wie der Einfluss von Folgetherapien auf die Prognose von Patienten mit molekularem Versagen. In Atlanta wurde deshalb eine Analyse von 2.061 erwachsenen ALL-Patienten präsentiert, die in der GMALL-Studie 07/03 oder mit dem dort verwendeten Protokoll im GMALL-Register behandelt wurden [2]. Die minimale Resterkrankung wurde für alle Patienten zentral im Referenzlabor an der Universität Kiel bestimmt; primäres Zielkriterium war das molekulare Ansprechen in Woche 16 der Therapie. Folgende Kategorien wurden unterschieden: Patienten mit molekularer Komplettremission mussten MRD-negativ sein bei einer Sensitivität von < 10-4, ein molekulares Versagen war durch einen positiven MRD-Nachweis (über 10-4) definiert, als MRD-positiv galten Patienten, bei denen unterhalb einer Sensitivität von 10-4 noch eine MRD gefunden wurde oder die nachgewiesene MRD nicht quantifizierbar war.
90% der Patienten wiesen zu diesem Zeitpunkt eine hämatologische Komplettremission auf, für 57% (n = 1.057) liegt ein MRD-Test in Woche 16 vor. Dieser Anteil hat mit der Zeit zugenommen: Im Zeitraum zwischen 2003 und 2009 lag er bei 53%, zwischen 2010 und 2016 war er auf 69% angestiegen. 60% der Patienten lebten nach fünf Jahren noch, bei 64% derer mit einer Remission dauert diese noch an. Die Raten hingen stark vom molekularen Ansprechen ab: Aus der Kohorte von Patienten mit molekularer Remission lebten noch 83%, 80% waren weiterhin in Remission. In der Kohorte mit molekularem Versagen waren es mit 43% bzw. 38% deutlich weniger. Patienten mit positivem MRD-Status (unter 10-4 oder nicht quantifizierbar – immerhin jeder sechste Patient) haben eine intermediäre Prognose (5-Jahres-Überleben 68%, andauernde Remission 56%) und sollten engmaschig nachverfolgt werden.
Die allogene Stammzelltransplantation bietet für Patienten mit molekularem Versagen Vorteile: 62% dieser Patienten, die keine molekulare Remission erreicht hatten, wurden in der ersten Komplettremission transplantiert (ebenfalls mit steigender Tendenz über die Zeit). Das resultierte in deutlich höheren 5-Jahres-Raten für Überleben (53% versus 28%; p < 0,0001) und vor allem für nach fünf Jahren anhaltende Remissionen (56% vs. 9%; p < 0,0001).
Dabei erschien es sinnvoll, vorher die Leukämielast zu reduzieren, um nach Möglichkeit eine molekulare Remission zu erreichen. Dafür ist allerdings eine weitere Chemotherapie wenig geeignet: Mit zielgerichteten Substanzen wie Blinatumomab waren die erreichten molekularen Komplettremissionsraten deutlich höher (91%) als mit einer Chemotherapie aus Methotrexat und pegylierter Asparaginase (24%) und auch höher als bei sofortiger Transplantation (75%).
Erforderlich erscheint für die Zukunft eine einheitliche Definition des MRD-Ansprechens, um vor allem die internationale Vergleichbarkeit von Studiendaten zu ermöglichen.
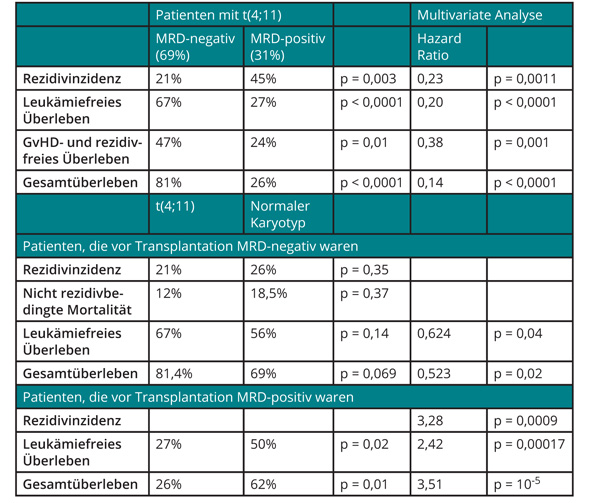
ALL mit t(4;11): MRD-Status vor Transplantation entscheidend
Patienten mit ALL und einer Translokation t(4;11) haben eine ungünstige Prognose, vor allem wegen eines erhöhten Rezidivrisikos, weshalb die meisten Expertengruppen hier eine allogene Stammzelltransplantation in der ersten Komplettremission als Therapie der Wahl favorisieren. Allerdings ist nie im Detail untersucht worden, wie die Prognose dabei tatsächlich ist und von welchen Faktoren sie abhängt. Die Acute Leukemia Working Party der European Group for Blood and Marrow Transplantation (EBMT) identifizierte daher in der EBMT-Datenbank 151 erwachsene ALL-Patienten mit t(4;11), die sich zwischen 2000 und 2016 einer allogenen Transplantation von einem gematchten verwandten oder nicht verwandten Spender unterzogen hatten. Analysiert wurde vor allem die Rolle des MRD-Status zum Zeitpunkt der Transplantation, und die Patienten wurden mit einer Kohorte von 567 Patienten verglichen, die an B-Vorläufer-ALL mit normalem Karyotyp litten [3].
Im Vergleich zum Kontrollkollektiv waren die Patienten mit t(4;11) älter, hatten höhere Leukozytenzahlen und ein kürzeres Intervall zur Transplantation und wurden häufiger von einem nicht verwandten Spender transplantiert. Zwei Jahre nach Transplantation wiesen 30% von ihnen ein Rezidiv auf, 19% waren an den Folgen der Transplantation verstorben, 51% waren leukämiefrei und 60% insgesamt noch am Leben. Nur 35% wiesen aber weder eine Graft-versus-Host-Reaktion (GvHD) noch ein Rezidiv auf. Der MRD-Status zum Zeitpunkt der Transplantation war wichtig für die Prognose (Tab. 1): MRD-negative Patienten (69%) schnitten nach zwei Jahren gegenüber MRD-positiven (31%) durchweg deutlich günstiger ab, sowohl was die Rezidivhäufigkeit (21% vs. 45%; p = 0,003) als auch das leukämiefreie Überleben (67% vs. 27%; p 0,0001) und die Freiheit von GvHD und Rezidiven anging (47% vs. 24%; p = 0,01). Dieser Vorteil der MRD-Negativität blieb auch in einer multivariaten Analyse aufrechterhalten, in die außerdem das Alter der Patienten und das Jahr der Transplantation eingingen.
Auch beim Vergleich mit den Patienten mit normalem Karyotyp zeigte sich ein starker Einfluss des MRD-Status: Von den MRD-negativen Patienten schnitten diejenigen mit t(4;11) mindestens so gut und tendenziell sogar etwas besser ab als die mit normalem Karyotyp (Rezidivhäufigkeit 21% vs. 26%; p = 0,35; nicht rezidivbedingte Mortalität 12% vs. 18,5%; p = 0,37; leukämiefreies Überleben 67% vs. 56%; p = 0,14; Gesamtüberleben 81% vs. 69%; p = 0,069). Bei den Patienten mit positivem MRD-Nachweis war es umgekehrt (leukämiefreies Überleben 27% vs. 50%; p = 0,02; Gesamtüberleben 26% vs. 62%; p = 0,01).
Die Daten dieser Registerstudie lassen interessante Schlussfolgerungen zu: Die Ergebnisse der allogenen Stammzelltransplantation bei Vorliegen einer t(4;11) erscheinen insgesamt sehr positiv, wobei die Rolle von Selektionseffekten unklar bleibt – die untersuchte Kohorte enthielt ja nur tatsächlich transplantierte Patienten. Deutlich wird außerdem auch hier die wichtige prognostische Rolle der MRD-Negativität vor der Transplantation: Man müsste deshalb eine weitere Verbesserung der Heilungschancen erwarten, wenn es gelänge, durch weitere therapeutische Maßnahmen bei noch mehr Patienten die minimale Resterkrankung vor der Transplantation zu eliminieren.