Bei Erwachsenen: geringeres Ansprechen, mehr Nebenwirkungen
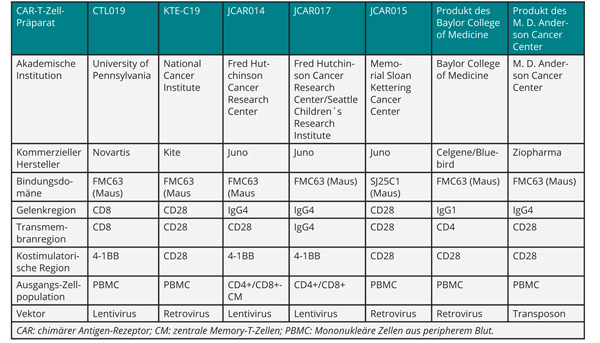
Für pädiatrische Patienten mit therapierefraktärer ALL, bei denen alle herkömmlichen Therapieoptionen versagt haben, gibt es seit einiger Zeit neue Hoffnung in Form von autologen T-Lymphozyten mit chimärem Antigen-Rezeptor (CAR-T-Zellen). Dabei wird in T-Zellen, die dem Patienten entnommen werden, auf gentechnischem Weg die Information für einen gegen ein Zelloberflächen-Antigen (im Fall der ALL das CD19-Antigen) gerichteten Rezeptor eingebracht. In den Körper reinfundiert, vermehren sich die zuvor in vitro expandierten zytotoxischen T-Zellen bei Anwesenheit des Antigens weiter und eliminieren die leukämischen Zellen. Zur Therapie lymphatischer, CD19-positiver B-Zell-Erkrankungen wurde bereits eine bemerkenswerte Liste von entsprechenden Präparaten entwickelt, die sich derzeit in klinischer Erprobung befinden (Tab. 3; [18]). Bei Kindern hat dieser Ansatz zu erstaunlichen Erfolgen und Heilungen in zuvor als hoffnungslos angesehenen Fällen geführt, die auch bereits in Zulassungen in den USA resultierten (in Europa wird in Kürze die erste Zulassung erwartet). Auch zu erwachsenen Patienten mit ALL wurden in Atlanta Ergebnisse aus klinischen Studien vorgestellt, von denen hier die Phase-I-Studie ZUMA-3 herausgegriffen sei [19]: