Beim letzten San Antonio Breast Cancer Symposium (SABCS) Anfang Dezember 2017 wurden erneut wegweisende Studienergebnisse zur Behandlung des frühen – d. h. noch nicht fernmetastasierten – Mammakarzinoms vorgestellt. So scheint jetzt klar zu sein, dass für die erweiterte adjuvante endokrine Therapien (d. h. nach fünfjähriger adjuvanter Therapie) eine Dauer von zwei Jahren ausreichend ist. Außerdem konnten die Vorteile von nab-Paclitaxel gegenüber konventionellem Paclitaxel in der neoadjuvanten Therapie bestätigt werden.
Erweiterte adjuvante Therapie über zwei Jahre ausreichend
Unmittelbare klinische Relevanz haben die Langzeitergebnisse der ABCSG-16-Studie bei postmenopausalen Patientinnen mit frühem Hormonrezeptor-positivem (HR+) Mammakarzinom. Sie zeigen, dass die erweiterte adjuvante Anastrozol-Gabe über zwei Jahre bei besserer Verträglichkeit genauso effektiv ist wie die erweiterte fünfjäh-rige Gabe des Aromatasehemmers (AI).
Patientinnen mit frühem HR+ Mammakarzinom haben ein signifikantes Langzeitrisiko für die Entwicklung von Rezidiven, erläuterte Studienleiter Michael Gnant, Comprehensive Cancer Center (CCC) der Medizinischen Universitätsklinik Wien. Dies sei die Rationale dafür, nach der klassischen fünfjährigen adjuvanten endokrinen Behandlung postmenopausale Patientinnen weiter mit einem Aromatasehemmer zu behandeln. Seit Jahren werde die Dauer dieser erweiterten adjuvanten Therapie diskutiert, für die bislang immer weitere fünf Jahre propagiert wurden. Die aktuellen Ergebnisse zeigten jedoch, dass dies nicht notwendig sei und dass man den Patientinnen mit der kürzeren Dauer Nebenwirkungen ersparen könne.
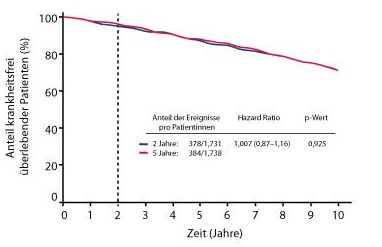
Die ABCSG-16-Studie (Austrian Breast and Colorectal Cancer Study Group) startete bereits 2004 mit fast 3.500 postmenopausalen Patientinnen mit frühem HR+ Mammakarzinom. Nach der 5-jährigen endokrinen Standardtherapie (nach Wahl des Arztes) wurden die Patientinnen mit Anastrozol über alternativ zwei oder fünf Jahre weiterbehandelt. Die Rate krankheitsfreier Patientinnen (DFS) nach zehn Jahren betrug 71,1% nach zweijähriger Anastrozol-Gabe versus 70,3% nach fünfjähriger Gabe (Hazard Ratio 1,007; p = 0,925; Abb. 1) Dies war unter anderem unabhängig vom Alter der Patientin (≤/> 60 Jahre) sowie vom Tumorstadium (pT1/pT2–3), vom Nodalstatus (pN0/pN+), vomG Grading (G1–3), von der Hormonrezeptor-Expression sowie von der endokrinen und einer potenziellen zytostatischen Vorbehandlung.
Zum Auswertungszeitpunkt (nach median 106,2 Monaten) waren in beiden Studienarmen noch etwa 85% der Patientinnen am Leben (HR 1,007; p = 0,947). Ebenfalls keine signifikanten Unterschiede konnten bei der Rate kontralateraler Mammakarzinome (3,5% nach zwei Jahren vs. 3,9% nach fünf Jahren; HR 1,134; p = 0,562) und bei der Rate sekundärer Neoplasien gezeigt werden (9,4% vs. 10,5%; HR 1,094; p = 0,477). Die Überlegung, dass eine schlechtere Therapie-Compliance bei fünfjähriger erweiterter endokriner Therapie die Ergebnisse verfälscht haben könnte, wird laut Gnant durch e explorative Adhärenz-Analyse entkräftet. Die Frakturrate hingegen lag unter zweijähriger Aromatasehemmer-Gabe signifikant niedriger (4,7% vs. 6,3%; HR 1,353; p = 0,053).
Gnant bezeichnete die zweijährige erweiterte adjuvante Aromatasehemmer-Therapie für postmenopausale Patientinnen als den zukünftigen Standard. Dennoch sei nicht auszuschließen, dass einzelne Patientinnen von einer fünfjährigen Aromatasehemmer-Gabe profitierten. Es sei daher wichtig, molekulare Marker zu identifizieren, um diese Patientinnen selektieren zu können.