Neue Therapieoptionen zur Behandlung der chronischen lymphatischen Leukämie
Die Behandlung von Patienten mit chronischer lymphatischer Leukämie (CLL) erfährt in den letzten Jahren durch die Zulassung neuer, zielgerichteter Substanzen und deren kontinuierliche Testung im Rahmen klinischer Studien erhebliche Fortschritte. Die Kombination eines CD20-Antikörpers mit Chemotherapie ist derzeit in der Erstlinienbehandlung von CLL-Patienten ohne zytogenetische oder molekulargenetische Risikofaktoren, unabhängig der körperlichen Fitness, als Standard anzusehen. Körperlich fitte Patienten erhalten hierbei eine Kombination aus Rituximab mit Fludarabin und Cyclophosphamid (FCR), oder – bei einem Alter von über 65 Jahren und einem damit verbundenen, größeren Infektionsrisiko – Rituximab und Bendamustin (BR). Bei Patienten mit relevanten Begleiterkrankungen wird Obinutuzumab (alternativ Ofatumumab oder Rituximab) mit Chlorambucil kombiniert. Zusätzlich zum Alter des Patienten und seinen Begleiterkrankungen muss das Vorhandensein einer del(17p)/TP53-Aberration für die Wahl des Therapieregimes berücksichtigt werden, da man hier von einer Unwirksamkeit der Chemoimmuntherapie ausgehen muss.
In den letzten Jahren wurden mehrere, auf den B-Zell-Rezeptor- (Ibrutinib, Idelalisib) bzw. den Apoptose-Signalweg zielende Substanzen (Venetoclax) zur Behandlung von Patienten mit CLL zugelassen. Insbesondere bei Vorliegen einer del(17p)/TP53-Abberation und in der Rezidivsituation haben diese Substanzen aufgrund ihrer guten Wirksamkeit und eines vorteilhaften Nebenwirkungsprofils einen festen Stellenwert. Durch die Kombination dieser und anderer neuer Wirkstoffe könnte die Behandlung der CLL weiter verbessert und somit das Überleben von CLL-Patienten verlängert werden. Abb. 2 kann der aktuell gültige Behandlungsalgorithmus entnommen werden.
Schlüsselwörter: Chronische lymphatische Leukämie (CLL), zielgerichtete Therapie, neue Substanzen
Bei der chronischen lymphatischen Leukämie (CLL) handelt es sich um ein niedrig-malignes Non-Hodgkin-Lymphom, das bislang als nicht heilbar gilt. Mit den derzeit etablierten Chemoimmuntherapien kann bei den meisten Patienten jedoch ein Überleben von mehreren Jahren erreicht werden. Durch die Zulassung und Weiterentwicklung neuerer, zielgerichteter Substanzen ergeben sich vielversprechende, alternative Behandlungskonzepte.
Die CLL wird aufgrund eines medianen Alters von 72 Jahren bei Diagnosestellung häufig als Alters-Leukämie bezeichnet. Bei den über 80-Jährigen wurde inzwischen ein Anstieg der Inzidenz auf mehr als 30 Fälle pro 100.000 Personen verzeichnet [1]. Mit einer Anzahl von 4,8 Neuerkrankungen pro 100.000 Einwohnern und Jahr ist die CLL auch insgesamt die häufigste Leukämie in den westlichen Ländern [1].
Gemäß der WHO-Klassifikation wird die CLL als kleinzelliges lymphozytisches Lymphom den Non-Hodgkin-Lymphomen zugeordnet. Typisch für die Erkrankung ist aber ein leukämischer Verlauf mit einem per definitionem bereits im frühen Stadium vorhandenen Knochenmark-Befall [2].
Man geht davon aus, dass die CLL durch genetische Veränderungen der hämatopoetischen Stammzellen entsteht. Aus diesen veränderten Stammzellen bilden sich monoklonale, CD5-positive B-Zell-Populationen [3]. Diese können mittels Immunphänotypisierung detektiert und mögliche Differenzialdiagnosen wie eine reaktive Lymphozytose oder andere niedrigmaligne Non-Hodgkin-Lymphome ausgeschlossen werden. Zur Diagnosestellung einer CLL muss eine Lymphozyten-Zahl ≥ 5.000/µl im peripheren Blut nachweisbar sein [4]. Die Durchführung einer Knochenmark-Punktion oder einer Lymphknoten-Biopsie ist nur bei einem nicht eindeutigen Befund der Immunphänotypisierung erforderlich.
Von einer monoklonalen B-Zell-Lymphozytose (MBL) spricht man bei einer Lymphozyten-Zahl unter 5.000/µl im peripheren Blut. Eine MBL findet man bei 0,5–5% der gesunden Bevölkerung. 1–2% dieser Fälle gehen pro Jahr in eine CLL über [5]. Ursächlich hierfür sind zusätzliche genetische Veränderungen sowie Interaktionen mit dem zellulären Umgebungsmilieu. Die monoklonalen Zellen wandern in die Lymphknoten und das Knochenmark ein und vermehren sich in pseudofollikulären Zentren weiter, um sich schließlich als CLL zu manifestieren [6].
Als Ursprungszellen der CLL werden zwei unterschiedliche Zelltypen angesehen: Gedächtnis-B-Zellen mit somatischen Mutationen der IGHV-Gene („Immunoglobulin Heavy chain Variable region“-Gene) nach Antigenkontakt oder naive B-Zellen ohne somatische Mutationen. Unmutierte IGHV-Gene findet man bei mehr als 40% der CLL-Patienten; sie sind mit einem deutlich erniedrigten medianen Überleben von 8 Jahren – verglichen mit 25 Jahren bei Patienten mit mutierten IGHV-Status – assoziiert [7, 8].
Behandlungsstrategien
Folgenden Kriterien sind für die Behandlungsstrategie bei der CLL entscheidend:
Stadium der CLL und Symptome
Die Stadieneinteilung der Erkrankung erfolgt, basierend auf dem körperlichen Untersuchungsbefund und dem Blutbild, nach Rai et al. [9] oder Binet et al. [10]. Beide Klassifikationen beruhen auf rein klinischen Parametern und bedürfen keiner Bildgebung.
Als krankheitsbedingte Symptome werden B-Symptome (Fieber, Nachtschweiß, Gewichtsverlust, Fatigue), aber auch Einschränkungen infolge von Zytopenien oder großen Lymphomen bezeichnet.
Körperliche Fitness und Komorbidität sowie eventuell Alter
Die Deutsche CLL-Studiengruppe (DCLLSG) verwendet zur Beurteilung der körperlichen Fitness den sogenannten kumulativen Krankheitsbewertungsscore (CIRS; [11]) und die glomeruläre Filtrationsrate (Kreatinin-Clearance), da diese Parameter das biologische Alter eines Patienten besser widerspiegeln als das kalendarische Alter.
Beim CIRS werden zwei Gruppen gebildet: „go go“ oder „slow go“. Um einen Patienten einer dieser Gruppen zuzuordnen, werden bei der Berechnung des CIRS die Belastung und die Schwere der Begleiterkrankungen in 14 Organsystemen mit bis zu vier Punkten in jeder Kategorie bewertet. Die Grenze zwischen „slow go“- und „go go“-Patienten, die für eine intensivere Chemoimmuntherapie infrage kommen, liegt bei einem CIRS-Gesamtscore von 6.
Risikofaktoren
Etablierte Risikofaktoren zur Definition einer Höchstrisiko-Erkrankung sind der Nachweis einer del(17p) in der zytogenetischen Testung oder eine molekulargenetisch nachgewiesene Aberration des auf Chromosom 17 liegenden Tumorsuppressor-Gens TP53. Beide sagen einen aggressiven Krankheitsverlauf sowie eine Resistenz gegen Chemotherapie vorher (20).
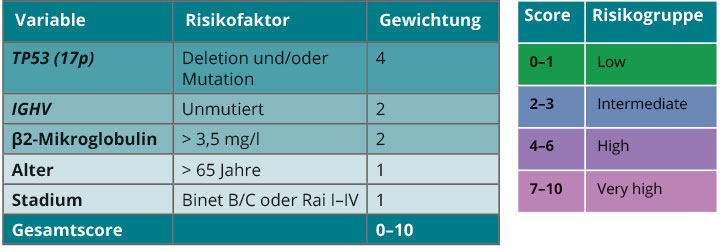
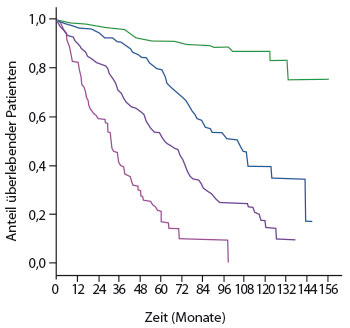
Eine unübersichtliche Fülle an weiteren prognostischen Markern wurde in den letzten Jahren beschrieben [12]. Durch eine internationale Arbeitsgruppe erfolgte die Entwicklung eines prognostischen Index für die CLL (CLL-IPI; [13]), welcher fünf unabhängige Prognosefaktoren, nämlich TP53-Mutation oder del(17p), IGHV-Mutationsstatus, β2-Mikroglobulin-Serumkonzentration, Erkrankungsstadium nach Rai oder Binet und das Alter berücksichtigt. Der CLL-IPI trennt hierbei vier Risikogruppen mit unterschiedlichen 5-Jahres-Überlebensraten: niedriges (93,2%), intermediäres (79,3%), hohes (63,3%) und sehr hohes Risiko (23,3%;
www.qxmd.com; Abb. 1).
Patienten im Binet-Stadium A ohne Behandlungsindikation
Ein abwartendes und beobachtendes Vorgehen („Watch & Wait“) ist der Standard für die Mehrzahl der CLL-Patienten.
Mit der randomisierten CLL7-Studie konnte diese Strategie bestätigt werden. Bei Patienten im Stadium Binet A ohne Symptome, aber mit einem hohen Risiko für einen schnellen Progress, wurde nämlich durch eine frühzeitige Chemoimmuntherapie mit einer Kombination aus dem Purin-Analogon Fludarabin und dem Alkylans Cyclophosphamid sowie dem gegen das CD20-Antigen gerichteten Antikörper Rituximab (FCR) im Vergleich zu „Watch & Wait“ das Gesamtüberleben nicht beeinflusst, obgleich das ereignisfreie Überleben durch die frühe Therapie mit FCR verlängert werden konnte [14].
Ob nun der Verlauf der Erkrankung bei dieser Patientengruppe durch den frühen Einsatz neuerer Substanzen positiv beeinflusst wird, ist derzeit nicht bekannt, wird aber in aktuell rekrutierenden Studien wie z. B. der CLL12-Studie getestet [15].
Patienten mit einer Indikation zur Behandlung
Eine Therapie ist unabhängig vom klinischen Stadium indiziert, wenn krankheitsbedingte Symptome auftreten oder Zeichen der Knochenmark-Verdrängung (Anämie, Thrombozytopenie), also ein Stadium Binet C, vorliegen.
Prinzipiell gilt eine Chemoimmuntherapie in der Erstlinientherapie der CLL als der etablierte Standard. In mehreren Phase-III-Studien konnte gezeigt werden, dass Patienten, die mit einer Kombination aus Chemotherapie und einem gegen das CD20-Antigen gerichteten Antiköper behandelt werden, einen Überlebensvorteil gegenüber Patienten haben, die sich einer alleinigen Behandlung mit Chemotherapie unterziehen [16–18].
Anhand der körperlichen Fitness und des Allgemeinzustands des Patienten wird hierbei die Intensität der eingesetzten Chemotherapie gewählt:
Bei körperlich fitten Patienten mit einem guten Allgemeinzustand sollte eine intensivere Chemoimmuntherapie als bei weniger fitten und komorbiden Patienten eingesetzt werden, um eine qualitativ sehr gute und damit langanhaltende komplette Remission zu erreichen.
Weniger fitte und komorbide Patienten, die als unfit bezeichnet werden müssen, profitieren von Chemoimmuntherapien, bei denen eine mildere Chemotherapie verwendet wird. Aufgrund der hiermit zu erzielenden, länger anhaltenden Remissionen muss heutzutage auch bei dieser Patientengruppe die Symptomkontrolle nicht länger als primäres Therapieziel definiert werden.
Durch die Zulassung neuer Substanzen verändert sich derzeit sowohl die Erstlinien- als auch die Rezidivtherapie der CLL erheblich [19–21].
Neue, zielgerichtete Substanzen
Der Inhibitor der Bruton-Tyrosinkinase (BTK) Ibrutinib zeigte in der Monotherapie bei therapienaiven und vorbehandelten Patienten mit CLL einschließlich Höchstrisiko-Patienten in den bislang durchgeführten Studien eine gute Wirksamkeit mit Ansprechraten von bis zu 86% und ein sicheres Nebenwirkungsprofil [22–24]. Gegenüber der alleinigen Therapie mit Chlorambucil konnte mit Ibrutinib in der Erstlinientherapie von Patienten mit über 65 Jahren ein deutlicher Überlebensvorteil beobachtet werden [24], sodass Ibrutinib inzwischen zur Behandlung von Patienten mit CLL in jeder Therapielinie, unabhängig vom Risikoprofil, zugelassen ist.
Der Phosphatidylinositol-3-Kinase-Delta(PI3Kδ)-Inhibitor Idelalisib (zuvor CAL-101) zeigt in Kombination mit Rituximab gegenüber alleiniger Rituximab-Therapie bei älteren, komorbiden Patienten mit vorbehandelter CLL eine klare Überlegenheit in der Wirksamkeit und führt zu einer deutlichen Verbesserung des Überlebens [19]. In mehreren klinischen Studien, in denen Idelalisib eingesetzt wurde, kam es jedoch zu vermehrten Infektionen und Todesfällen. Die Zulassung der Substanz wurde deshalb in der Erstlinientherapie in Kombination mit Rituximab auf Patienten mit ungünstiger Prognose durch Nachweis einer del(17p) oder TP53-Aberration beschränkt, bei denen gleichzeitig, z. B. aufgrund von Komorbiditäten, keine andere Behandlung infrage kommt. Für die Rezidivtherapie gibt es bei der Zulassung von Idelalisib in Kombination mit Rituximab keine Einschränkungen.
Seit Dezember 2016 ist der Bcl-2-Inhibitor Venetoclax (zuvor ABT-199) auch in Deutschland als Monotherapie bei Patienten mit del(17p) oder TP53-Aberration zugelassen, wenn Ibrutinib und Idelalisib nicht geeignet sind oder versagt haben, außerdem bei Patienten ohne del(17p) oder TP53-Mutation, wenn Behandlungen mit Chemoimmuntherapie und Inhibitoren des B-Zell-Rezeptor-Signalwegs versagt haben. Basis hierfür bildet die einarmige Phase-II-Studie M13-982, bei der 106 Patienten mit del(17p), die mindestens eine vorherige Behandlung erhalten hatten, unter einer Monotherapie mit Venetoclax eine Gesamtansprechrate von 79,4% erreichten [21]. In dieser und anderen Studien konnten sowohl komplette Remissionen als auch das Fehlen einer minimalen Resterkrankung (Minimal Residual Disease = MRD) im peripheren Blut (MRD-Negativität) beobachtet werden, sodass diese Substanzgruppe als Monotherapie oder auch in Kombination mit einem CD20-Antikörper möglicherweise effektiver ist als die Kinaseinhibitoren Ibrutinib oder Idelalisib. Aufgrund des raschen Ansprechens kann es jedoch zu einem Tumorlyse-Syndrom (TLS) kommen, sodass die Substanz langsam in ihrer Dosis gesteigert werden muss.
Erstlinientherapie
Erstlinientherapie bei körperlich fitten Patienten ohne Höchstrisiko
Körperlich fitte Patienten mit wenigen Begleiterkrankungen erhalten als Erstlinientherapie eine intensivere Chemoimmuntherapie mit FCR. Durch eine Primärtherapie mit FCR kann eine Ansprechrate von 90% mit 44% kompletten Remissionen erreicht und das Gesamtüberleben gegenüber einer alleinigen Chemotherapie mit Fludarabin und Cyclophosphamid signifikant verlängert werden [16, 18]. Insbesondere Patienten mit mutiertem IGHV erreichen nach einer Therapie mit FCR langanhaltende Remissionen; bei mehr als der Hälfte dieser Patienten wurden auch nach einer Nachbeobachtungszeit von sechs bis zwölf Jahren keine Krankheitsrückfälle beobachtet [16, 25]. Hauptnebenwirkungen der Therapie sind neben einer ausgeprägten Myelotoxizität schwere Infektionen, vor allem bei über 65-jährigen Patienten [26].
Aus diesem Grund sollte bei fitten, aber älteren Patienten, insbesondere, wenn es in der Vorgeschichte zu Infektionen gekommen ist, eine Kombinationstherapie mit dem Alkylans Bendamustin und Rituximab (BR) erwogen werden. Mit diesem Regime konnte in einer Phase-II-Studie in der Erstlinientherapie eine Ansprechrate von 88% erreicht werden [27]. Im direkten Vergleich in der Erstlinientherapie fitter Patienten zeigte sich jedoch, dass BR der Kombination FCR in Bezug auf die Dauer des rezidivfreien Überlebens (42 vs. 56 Monate) und das Erreichen kompletter Remissionen signifikant unterlegen war [26].
Durch den Einsatz des durch Glyko-„Engineering“ optimierten CD20-Antikörpers Obinutuzumab (vormals GA101), kann die Wirksamkeit der Chemoimmuntherapie möglicherweise weiter gesteigert werden. Allerdings fanden sich im indirekten Vergleich zu BR und FCR bei der Kombination dieses Antikörpers mit Bendamustin oder FC auch mehr Nebenwirkungen [28], sodass der Nutzen nicht erwiesen ist.
Ibrutinib ist, wie oben dargestellt, ebenfalls zur Erstlinienbehandlung fitter Patienten mit CLL zugelassen. Die Zulassung basiert auf der RESONATE2-Studie, welche lediglich ältere, über 65-jährige Patienten einschloss und Ibrutinib mit einer Chlorambucil-Monotherapie verglich. Es konnte zwar gezeigt werden, dass Ibrutinib das Gesamtüberleben ohne zusätzliche Nebenwirkungen signifikant verlängert [24], ein direkter Vergleich zwischen den intensiveren Chemoimmuntherapien FCR oder BR und Ibrutinib existiert derzeit aber nicht. Somit sollte bei dieser Patientengruppe der altbewährten Chemoimmuntherapie der Vorzug gegeben werden, solange keine Kontraindikationen bestehen.
Im Rahmen der aktuell rekrutierenden, international durchgeführten CLL13-Studie der DCLLSG soll bei fitten Patienten ohne Nachweis einer del(17p) oder TP53-Aberration in einem randomisierten Studienprotokoll gezeigt werden, dass Chemotherapie-freie Therapieregimes der Chemoimmuntherapie in der Erstlinienbehandlung überlegen sind, um zukünftig die Chemotherapie in der Behandlung der CLL vollständig durch zielgerichtete Substanzen zu ersetzen. Getestet werden neben einer Kombination aus Venetoclax und Rituximab (RVe) eine Kombination aus Venetoclax und Obinutuzumab (GVe) sowie eine Kombination aus Venetoclax, Obinutuzumab und Ibrutinib (GIVe).
Erstlinientherapie bei Patienten mit Begleiterkrankungen ohne Höchstrisiko
Da bei Patienten mit relevanter Komorbidität die Standardtherapie mit FCR nicht durchführbar ist, erhalten sie weniger intensive Chemoimmuntherapien, bestehend aus dem Alkylans Chlorambucil in Kombination mit einem CD20-Antikörper (Rituximab, Ofatumumab oder Obinutuzumab).
Ein direkter Vergleich der drei Antikörper existiert nicht, jedoch erscheint die Kombination mit Obinutuzumab am effektivsten. Im Rahmen der CLL11-Studie erwies sich nämlich Obinutuzumab in Kombination mit Chlorambucil bei Patienten mit Vorliegen relevanter Komorbiditäten gegenüber Rituximab, ebenfalls in Kombination mit Chlorambucil, als überlegen. Beide Antikörper-haltigen Arme zeigten darüber hinaus gegenüber der alleinigen Therapie mit Chlorambucil ein signifikant längeres progressionsfreies Überleben (11 Monate mit Chlorambucil versus 15 Monate mit Chlorambucil und Rituximab versus 29 Monate mit Chlorambucil und Obinutuzumab; [17, 29]).
Durch die Kombinationstherapie aus Ofatumumab und Chlorambucil hingegen konnte im Rahmen der COMPLEMENT-Studie ein progressionsfreies Überleben von 22 Monaten gezeigt werden. In dieser Studie wurde Ofatumumab in Kombination mit Chlorambucil in der Erstlinientherapie bei Patienten, die aufgrund von Begleiterkrankungen nicht fit genug für eine Fludarabin-haltige Chemoimmuntherapie waren, gegenüber Chlorambucil alleine getestet. Die alleinige Chlorambucil-Therapie zeigte hierbei ein progressionsfreies Überleben von 13 Monaten, das mit dem in der CLL11-Studie erreichten vergleichbar ist; ein Vorteil bezüglich des Gesamtüberlebens ergab sich nicht [30].
Sowohl in der COMPLEMENT- als auch in der CLL11-Studie zeigte sich in den CD20-Antikörper-haltigen Kombinationsarmen eine höhere Rate an Hämatotoxizität, aber kein Unterschied in der Inzidenz der unter der Therapie auftretenden Infektionen [17, 30]. Eine Kombinationstherapie lässt sich somit auch in dieser komorbiden Patientengruppe sicher durchführen.
Ibrutinib ist, basierend auf dem in der RESONATE-2-Studie gezeigten und weiter oben beschriebenen Überlebensvorteil gegenüber der Monotherapie mit Chlorambucil [24], als Monotherapie eine mögliche Alternative in der Erstlinienbehandlung älterer, komorbider Patienten. Ein direkter Vergleich zwischen einer Monotherapie mit Ibrutinib und der Kombination aus Chlorambucil und einem CD20-Antikörper existiert jedoch ebenso wenig wie ein Vergleich mit Chemoimmuntherapie bei fitten Patienten.
Im Rahmen des CLL14-Protokolls der DCLLSG wurde getestet, ob die Chemoimmuntherapie mit Chlorambucil und Obinutuzumab bei älteren, komorbiden Patienten durch die Chemotherapie-freie Kombination aus Venetoclax und Obinutuzumab ersetzt werden kann. Erste Ergebnisse der Safety-Run-in-Phase zeigen, dass die Kombination aus Venetoclax und Obinutuzumab sicher und mit einer Gesamtansprechrate von 100% äußerst effektiv ist [31]. Die Kombination könnte somit bald den neuen Standard in diesem Patientenkollektiv darstellen.
Erstlinientherapie bei Höchstrisiko-CLL (del(17p) und/oder TP53-Aberration)
Höchstrisiko-Patienten sollten unabhängig von der körperlichen Verfassung nicht mit Chemotherapie, sondern mit Ibrutinib oder mit der Kombination aus Idelalisib und Rituximab, also mit einem der in dieser Indikation zugelassenen Tyrosinkinase-Inhibitoren (TKI), behandelt werden. Eine zytogenetische und molekulargenetische Untersuchung ist somit vor Einleitung einer Therapie bei jedem CLL-Patienten unabdingbar. Im Rahmen der aktuell rekrutierenden CLL2-GIVe-Studie der DCLLSG wird sogar die Behandlung mit einer Dreierkombination, bestehend aus Ibrutinib in Kombination mit Venetoclax und dem CD20-Antikörper Obinutuzumab, getestet.
In der Vergangenheit war die allogene Stammzelltransplantation (HSCTx) bei jüngeren bzw. fitten Patienten mit Höchstrisiko in erster Remission indiziert. Aufgrund der Möglichkeit einer Erstlinientherapie mit einem Kinaseinhibitor kann die HSCTx für diese Patienten nun je nach Risikoabwägung in der Therapiefolge nach hinten geschoben werden, zumal die therapieassoziierte Mortalität auch mit dosisreduzierten Konditionierungsschemata bis zu 20% beträgt [32, 33].
Weitere, alternative Therapieoptionen sind durch den Einsatz des monoklonalen CD52-Antikörpers Alemtuzumab, dessen Marktzulassung allerdings bereits vor mehreren Jahren durch die Herstellerfirma zurückgegeben wurde, sowie durch eine Hochdosistherapie mit einem CD20-Antikörper (Rituximab oder Ofatumumab) gegeben.
Rezidivtherapie
Vor einer Rezidivtherapie sollte aufgrund der möglichen genetischen Evolution der Erkrankung und des damit verbundenen möglichen Neuauftretens einer prognostisch ungünstigen genetischen Veränderung die zytogenetische und molekulargenetische Testung wiederholt werden. Finden sich hierbei keine neu aufgetretene del(17p) bzw. TP53-Aberration, ist für die Wahl der Rezidivtherapie die Dauer der Remission nach Erstlinientherapie entscheidend:
Patienten, die nach der initialen Chemoimmuntherapie mindestens drei Jahre lang in Remission waren, können die Erstlinientherapie erneut erhalten. Komorbiden Patienten, die zuvor Chlorambucil in Kombination mit einem CD20-Antikörper erhalten haben, kann alternativ eine Kombination aus Bendamustin mit einem CD20-Antikörper verabreicht werden.
Ein frühes Rezidiv der CLL innerhalb von drei Jahren nach der initialen Chemoimmuntherapie entspricht ebenso wie das Vorliegen genetischer Risikofaktoren einer schlechteren Prognose. In dieser Situation sollten Patienten daher mit einem TKI oder Venetoclax behandelt werden. Weitere, alternative Therapieoptionen sind in Abb. 2 dargestellt.
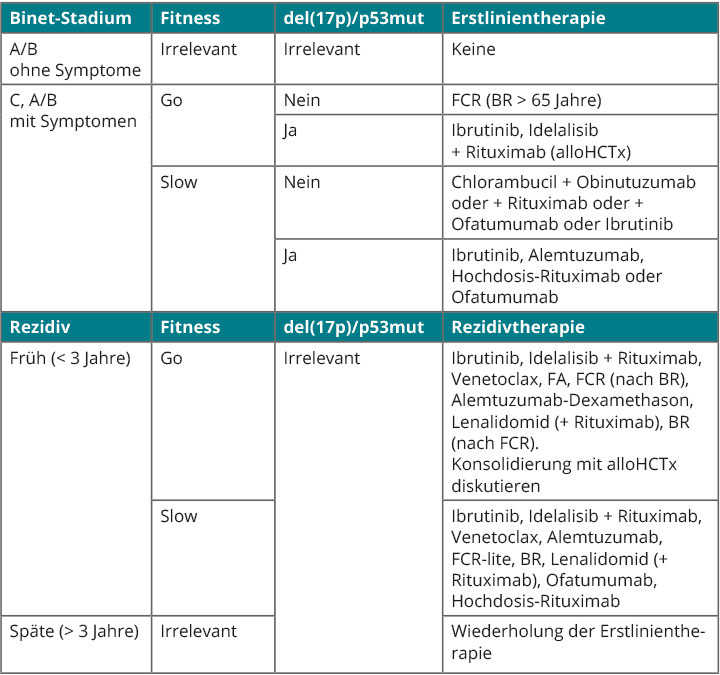
Im Rahmen klinischer Studien werden kontinuierlich weitere neue Substanzen mit verschiedenen Mechanismen, unter anderem mit immunmodulatorischen Effekten, getestet. Der Stellenwert dieser Substanzen wird sich in den kommenden Jahren herauskristallisieren. Die Behandlung innerhalb einer klinischen Studie sollte in der Rezidivsituation und insbesondere bei Verläufen mit mehreren Rezidiven dringend angestrebt werden.
Eine HSCTx sollte bei Vorliegen eines Rezidivs bei jüngeren, körperlich fitten Patienten aufgrund der unklaren Remissionsdauer mit den neuen Substanzen unbedingt erwogen werden.
MRD-gesteuerte Therapiekonzepte
Basierend auf dem sogenannten Triple-T-Konzept einer zielgerichteten („targeted“) und personalisierten („tailored“) Therapie mit dem Ziel der kompletten Elimination der CLL („total eradication of MRD“) hat die DCLLSG mehrere, identische klinische Studien (BXX-Konzept) initiiert. Patienten erhalten hierbei in Abhängigkeit von der Tumormasse zunächst ein (optionales) Debulking, bestehend aus zwei Zyklen Bendamustin. Das wird gefolgt von sechs Zyklen einer Induktionstherapie, bestehend aus einer Kombination aus einer der neuen, oralen Substanzen (Ibrutinib, Idelalisib oder Venetoclax) mit einem CD20-Antikörper (Obinutuzumab oder Ofatumumab). MRD-gesteuert wird diese Therapie als Erhaltungstherapie fortgeführt. Dieses Konzept ist bislang nicht in der Standardbehandlung der CLL etabliert, zeigt aber erste vielversprechende Ergebnisse.
Literatur
1. Howlader N et al. (eds.) SEER Cancer Statistics Review, 1975-2011, National Cancer Institute, Bethesda, MD. seer.cancer.gov/csr/1975_2011/, based on November 2013 SEER data submission, posted to the SEER web site, April 2014., 2014.
2. Swerdlow SH et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Fourth edition 2008, WHO Press.
3. Rozman C, Montserrat E. Chronic lymphocytic leukemia. N Engl J Med 1995; 333: 1052-7.
4. Hallek M et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: A report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 2008; 111: 5446-56.
5. Rawstron AC et al. Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia. N Engl J Med 2008; 359: 575-83.
6. Caligaris-Cappio F et al. How the microenvironment wires the natural history of chronic lymphocytic leukemia. Semin Cancer Biol 2014; 24: 43-8.
7. Damle RN et al. Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999; 94: 1840-7.
8. Hamblin TJ et al. Unmutated Ig V(H) genes are associated with a more aggressive form of chronic lymphocytic leukemia. Blood 1999; 94: 1848-54.
9. Rai KR et al. Clinical staging of chronic lymphocytic leukemia. Blood 1975; 46: 219-34.
10. Binet JL et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981; 48: 198-206.
11. Salvi F et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly patients. J Am Geriatr Soc 2008; 56: 1926-31.
12. Landau DA et al. Mutations driving CLL and their evolution in progression and relapse. Nature 2015; 526: 525-30.
13. International CLL-IPI working Group. An international prognostic index for patients with chronic lymphocytic leukaemia (CLL-IPI): A meta-analysis of individual patient data. Lancet Oncol 2016; 17: 779-90.
14. Schweighofer CD et al. Early versus deferred treatment with combined fludarabine, cyclophosphamide and rituximab (FCR) improves event-free survival in patients with high-risk Binet stage A chronic lymphocytic leukemia – first results of a randomized German-French cooperative phase III trial. Blood 2013; 122 (ASH 2013, Abstract #524).
15. Langerbeins P et al. The CLL12 trial protocol: A placebo-controlled double-blind Phase III study of ibrutinib in the treatment of early-stage chronic lymphocytic leukemia patients with risk of early disease progression. Future Oncol 2015; 11: 1895-903.
16. Fischer K et al. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: Updated results of the CLL8 trial. Blood 2016; 127: 208-215.
17. Goede V et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370: 1101-10.
18. Hallek M et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: A randomised, open-label, phase 3 trial. Lancet 2010; 376: 1164-74.
19. Furman RR et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014; 370: 997-1007.
20. Byrd JC et al. Ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013; 369: 1278-9.
21. Stilgenbauer S et al. Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion: A multicentre, open-label, phase 2 study. Lancet Oncol 2016; 17: 768-78.
22. Byrd JC et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013; 369: 32-42.
23. O'Brien S et al. Ibrutinib as initial therapy for elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: An open-label, multicentre, phase 1b/2 trial. Lancet Oncol 2014; 15: 48-58.
24. Burger JA et al. Ibrutinib as initial therapy for patients with chronic lymphocytic leukemia. N Engl J Med 2015; 373: 2425-37.
25. Thompson PA, Wierda WG. Eliminating minimal residual disease as a therapeutic end point: Working toward cure for patients with CLL. Blood 2016; 127: 279-86.
26. Eichhorst B et al. Frontline chemoimmunotherapy with fludarabine (F), cyclophosphamide (C), and rituximab (R) (FCR) shows superior efficacy in comparison to bendamustine (B) and rituximab (BR) in previously untreated and physically fit patients (pts) with advanced chronic lymphocytic leukemia (CLL): Final analysis of an international, randomized study of the German CLL Study Group (GCLLSG) (CLL10 Study). Blood 2014; 124 (ASH 2014, Abstract #19).
27. Fischer K et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: A multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2012; 30: 3209-16.
28. Bosch F et al. Preliminary safety results from the phase IIIb GREEN study of obinutuzumab (GA101) alone or in combination with chemotherapy for previously untreated or relapsed/refractory chronic lymphocytic leukemia (CLL). Blood 2014; 124 (ASH 2014, Abstract #3345).
29. Goede V et al. Obinutuzumab (GA101) plus chlorambucil (Clb) or rituximab (R) plus Clb versus Clb alone in patients with chronic lymphocytic leukemia (CLL) and preexisting medical conditions (comorbidities): Final stage 1 results of the CLL11 (BO21004) phase III trial. J Clin Oncol 2013; 31, Suppl 15 (ASCO 2013, Abstract #7004).
30. Hillmen P et al. Chlorambucil plus ofatumumab versus chlorambucil alone in previously untreated patients with chronic lymphocytic leukaemia (COMPLEMENT 1): A randomised, multicentre, open-label phase 3 trial. Lancet 2015; 385: 1873-83.
31. Fischer K et al. Venetoclax and obinutuzumab in chronic lymphocytic leukemia. Blood 2017; 129: 2702-5.
32. Dreger P et al. Allogeneic stem cell transplantation provides durable disease control in poor-risk chronic lymphocytic leukemia: Long-term clinical and MRD results of the GCLLSG CLL3X trial. Blood 2010; 116: 2438-47.
33. Dreger P et al. Managing high-risk chronic lymphocytic leukemia during transition to a new treatment era: Stem cell transplantation or novel agents? Blood 2014; 124: 3841-9.
34. Eichhorst B et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 (suppl 5): v78-v84.
35. Eichhorst B et al. appendix 6: Chronic lymphocytic leukaemia: eUpdate published online September 2016 (http://www.esmo.org/Guidelines/Haematological-Malignancies). Ann Oncol 20176; 27 (suppl 5): v143-v144.
36. Wendtner CM et al. Chronisch lymphatische Leukämie (CLL). www.onkopedia.com/de/onkopedia/guidelines/chronische-lymphatische-leukaemie-cll/@@view/html/index.html (Stand: Januar 2017).

Dr. med. Julia v. Tresckow (korr. Autorin)

PD Dr. med. Barbara Eichhorst

Prof. Dr. med. Michael Hallek
Klinik I für Innere Medizin
Universitätsklinikum Köln
Kerpener Str. 62, 50937 Köln
+49 221 478 88220
+49 221 478 86886
Julia.von-tresckow[at]uk-koeln[dot]de