Der World Congress on Gastrointestinal Cancer (WCGC) in Barcelona findet immer wenige Wochen nach der Jahrestagung der American Society for Medical Oncology (ASCO) in Chicago statt, und wir berichten hier von beiden Kongressen über die Neuigkeiten zu gastrointestinalen Tumoren – wobei wir auf die kolorektalen Lokalisationen verzichten, weil es dazu im nächsten Heft von Trillium Krebsmedizin einen eigenen Schwerpunkt geben wird.
Das Pankreaskarzinom liegt in Deutschland bei der Inzidenz laut Robert-Koch-Institut bei Männern an zehnter, bei Frauen an sechster, bezüglich der Mortalität aber jeweils an vierter Stelle [1]. Dieses Missverhältnis zwischen Inzidenz und Sterblichkeit illustriert die nach wie vor schlechten Therapiemöglichkeiten: Das Pankreaskarzinom wird gegen alle bisher getesteten Therapien rasch resistent oder ist bereits primär refraktär dagegen.
Ein Grund dafür ist ein erhöhter intratumoraler Druck, u. a. durch Anreicherung des hochmolekularen Polysaccharids Hyaluronan im Tumorstroma. Dadurch werden die Gefäße komprimiert und der Einstrom von Medikamenten mit dem Blut behindert; die Hyaluronan-Akkumulation ist ein negativer Prädiktor für das Überleben dieser Patienten. Das Polysaccharid kann durch Hyaluronidase abgebaut werden; eine pegylierte Form dieses Enzyms (PEGPH20) wurde in einer Phase-II-Studie getestet, die Sunil Hingorani, Seattle, in Chicago und Andrew Hendifar, Los Angeles, in Barcelona vorstellten [2, 3]: Darin erhielten 279 Patienten mit nicht vorbehandeltem metastasiertem Pankreaskarzinom randomisiert eine Kombination aus nab-Paclitaxel und Gemcitabin alleine oder zusammen mit PEGPH20.
Beim primären Endpunkt progressionsfreies Überleben (PFS) erreichte die Enzymtherapie im Gesamtkollektiv einen signifikanten Vorteil (Hazard Ratio 0,73; p = 0,045). Wirklich erfolgreich war die Behandlung aber bei den etwa 30% der Patienten mit hoher Hyaluronan-Konzentration im Tumorstroma, wie Andrea Bullock, Boston, beim WCGC in einer Subgruppenanalyse zeigte: Hier wurde das mediane PFS von 5,2 auf 9,2 Monate verlängert (HR 0,51; p = 0,048); bei Patienten mit niedrigen Werten war kein Unterschied erkennbar [4]. Das Gesamtüberleben (OS) zeigten einen deutlichen Unterschied bei den Medianwerten (11,5 vs. 8,5 Monate), aber keine Signifikanz (HR 0,96).
Dieser erste Ansatz, bei dem ein Marker aus dem Tumor-Microenvironment zur Selektion von Patienten für die Behandlung mit einem Medikament mit molekularem Ansatz verwendet wird, soll nun in einer Phase-III-Studie weiter untersucht werden: Darin werden auch in deutschen Zentren mehr als 400 Patienten mit hohem Hyaluronan-Gehalt im Pankreaskarzinom im Verhältnis 2 : 1 die Dreierkombination oder die Chemotherapie alleine erhalten. Primäre Endpunkte sind PFS und OS [5].
Pegyliertes Interleukin-10 mit Chemotherapie
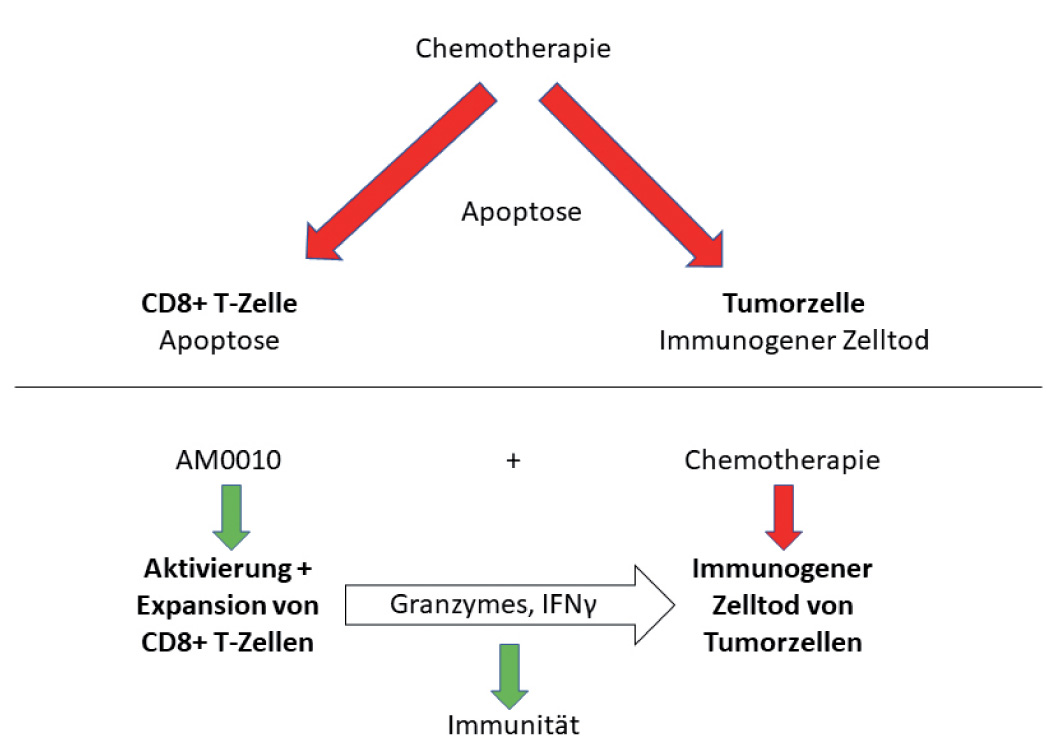
Auch Immuntherapien wie Checkpoint-Inhibitoren oder Vakzinen haben die Prognose des Pankreaskarzinoms bislang nicht nennenswert verbessert. Ein neuer Ansatz ist eine Stimulation von T-Lymphozyten mit Interleukin 10 (IL-10), das in niedriger Konzentration antiinflammatorisch wirkt, in hoher Konzentration aber tumorinfiltrierende, CD8-positive T-Zellen zu Proliferation und Zytotoxizität stimuliert. Außerdem wurde bei einer Reihe maligner Tumoren die klonale Expansion neuer T-Zell-Klone induziert, und für eine pegylierte Form von IL-10 (AM0010) konnte in präklinischen Modellen die Eradikation solider Tumoren nachgewiesen werden.
Besonders interessant erscheint eine synergistische Wirkung von AM0010 mit Standard-Chemotherapien: Oxaliplatin etwa induziert zwar den Zerfall von Tumorzellen, wobei immunogene Stoffe freigesetzt werden, treibt andererseits aber auch CD8-positive T-Zellen in die Apoptose, sodass es zu keiner nennenswerten immunologischen Anti-Tumor-Antwort kommt. Gleichzeitig gegebenes AM0010 schützt die T-Zellen vor der Apoptose und aktiviert in ihnen zytotoxische Mechanismen, die eine starke Immunreaktion gegen den Tumor bewirken (Abb. 1).
In einer Phase-Ib-Studie wurde AM0010 in Monotherapie sowie in Kombination mit Chemo- oder Immuntherapien bei verschiedenen Tumoren (Pankreas-, triple-negatives Mamma-, nicht-kleinzelliges Lungen und Nierenzellkarzinom sowie Melanom) getestet. 22 Patienten mit Pankreaskarzinom erhielten als mindestens dritte Therapielinie das Zytokin in Monotherapie, 21 weitere Patienten in Zweit- oder höherer Linie eine Kombination daraus mit einer FOLFOX-Chemotherapie. Letztere durften vorher Gemcitabin, aber kein Platin erhalten haben.
Wie Randolph Hecht, Santa Monica, in Barcelona, berichtete, zeigte die Sicherheitsauswertung, dass AM0010 keine Autoimmun-Reaktionen zu verursachen scheint; die häufigsten Toxizitäten waren Anämien und Thrombozytopenien, die aber durch die Änderung des Dosierungsschemas mit zwei Tagen Pause pro Woche gut kontrollierbar waren [6].
AM0010 in Monotherapie führte lediglich zu einer Krankheitsstabilisierung in etwa der Hälfte der Fälle, und medianes PFS und OS lagen mit 1,7 bzw. 3,8 Monaten im gleichen Bereich wie in einer historischen Kontrollkohorte unter alleiniger FOLFOX-Therapie. Die Immun-Chemotherapie-Kombination hingegen führte neben drei Remissionen (davon zwei komplette) zu zehn Krankheitsstabilisierungen und konnten PFS und OS mehr als verdoppeln (auf median 3,5 bzw. 10,2 Monate). Die Überlebenskurve könnte auf ein Langzeitüberleben bei einigen Patienten hindeuten, enthält aber noch zu viele zensierte Patientendaten, um eine sichere Aussage zu gestatten. Auch die CA19-9-Titer wurden in dieser Kohorte bei mehr als der Hälfte der Patienten um mehr als 20%, bei 42% sogar um mehr als 60% reduziert. Das Gesamtüberleben korrelierte in einer vorläufigen Auswertung mit der Häufigkeit tumorinfiltrierender CD8-positiver T-Zellen im Tumor vor Beginn der Therapie, und auch die Expansion dieser Zellen ging mit einer besseren Prognose einher. In einer globalen Phase-III-Studie wird die Kombination nun randomisiert gegen die FOLFOX-Therapie alleine getestet [7].