Reaktive Sauerstoffspezies (ROS) sind eine Gruppe von reaktiven Sauerstoffmolekülen, welche durch verschiedene zelluläre Vorgänge entstehen können. Zunächst wurden ROS lediglich mit zellschädigenden Vorgängen und dem Zelltod in Verbindung gebracht. Neuere Studien zeigen jedoch, dass ROS wichtige Signalmoleküle sind, welche viele immunologische Vorgänge und den Zellstoffwechsel beeinflussen. Zelluläre ROS-Konzentrationen müssen optimal austariert sein, um die Funktionalität der Zellen zu gewährleisten. Dies bedingt eine regulierte ROS-Produktion und deren kontrollierte Inaktivierung durch Antioxidantien, welche den zellulären Redoxstatus einer Zelle definieren. In diesem Artikel werden die ROS-generierenden und -inaktivierenden Prozesse besprochen und ihr Einfluss auf die Signalleitung, den Metabolismus und die Auswirkungen von immunologischen Effektorfunktionen am Beispiel von T-Zellen diskutiert.
Schlüsselwörter: ROS, Antioxidantien, Metabolismus, T-Zellen
Einleitung
Zellulärer oxidativer Stress wird durch Reaktive Sauerstoffspezies (engl. Reactive Oxygen Species, ROS) hervorgerufen und spielt bei der Zellalterung, dem Zelltod und vielen Erkrankungen wie z. B. Krebs oder Autoimmunität eine entscheidende Rolle [1, 2]. Neben diesen negativen Auswirkungen sind ROS auch zelluläre Signalmediatoren, welche beispielsweise wichtige Funktionen und metabolische Prozesse in Immunzellen regulieren [2, 3]. Als ROS bezeichnet man eine heterogene Gruppe von Sauerstoff(O)-Verbindungen, welche durch eine partielle Reduktion von elementarem Sauerstoff (O2) gebildet werden. Dazu gehören unter anderem Wasserstoffperoxid (H2O2), das Superoxid Anion (O2•‒, auch als Hyperoxid-Anion bezeichnet) und das Hydroxyl-Radikal (OH•). ROS-Verbindungen zeichnen sich insbesondere durch ihre hohe chemische Reaktionsfähigkeit aus und können zur oxidativen Schädigung von DNA, Proteinen und Lipiden führen. Die Sauerstoffradikale OH• und O2•‒ sind sehr reaktiv, aber von sehr kurzer Halbwertszeit, und daher in geringerem Ausmaß an einer Zellschädigung beteiligt, als das stabilere H2O2 [4]. Allerdings kann O2•‒ durch die Aktivität der Superoxid-Dismutase (SOD) in H2O2 umgewandelt werden.
ROS werden in jeder Zelle gebildet
ROS können durch verschiedene zelluläre Vorgänge gebildet werden, hauptsächlich durch mitochondriale Respiration oder durch die Aktivität der NADPH-Oxidasen (NOXs) [5]. Ein geringer Teil des im Zellstoffwechsel verbrauchten Sauerstoffs wird in Mitochondrien in ROS (mROS) umgewandelt, wofür der Elektronentransport durch die mitochondriale Atmungskette entscheidend ist. In diesem sehr effizienten Vorgang werden Elektronen von Nicotinamid-Adenin-Dinukleotid (NADH) und Flavin-Adenin-Dinukleotid (FADH2) über verschiedene mitochondriale Proteinkomplexe (I–IV) auf den terminalen Elektronenakzeptor Sauerstoff übertragen und dieser zu H2O reduziert. Eine kleine Anzahl der Elektronen, etwa 0,1–2%, gehen in diesem Transport verloren und werden in einer nicht-enzymatischen Reaktion direkt auf Sauerstoff übertragen, was zu einer partiellen Reduktion und der Bildung von O2•‒ führt [6]. Es konnte gezeigt werden, dass die Komplexe I und III der Atmungskette entscheidend für die Bildung von O2•‒ sind [5]. Anschließend kann O2•‒ über spannungsabhängige Anionen-Kanäle (VDAC) in das Zytoplasma gelangen, wo es von der SOD in H2O2 konvertiert wird [6].
Zusätzlich zu Mitochondrien werden ROS auch von Mitgliedern der NOX-Protein-Familie generiert, die in der Zellmembran lokalisiert sind. Dabei handelt es sich um Enzym-Komplexe, die je nach Lage und Zusammensetzung O2•‒ in den extrazellulären oder intrazellulären Raum abgeben können. Entsprechend sind die unterschiedlichen NOX-Isoformen in verschiedenen Organellen wie dem Mitochondrium, dem endoplasmatischen Retikulum oder der nuklearen Membran lokalisiert. NOX-Enzyme der Plasmamembran sind beispielsweise entscheidend für den „oxidativen Burst“ von Zellen des angeborenen Immunsystems wie Neutrophile und Makrophagen bei der Phagozytose von Pathogenen. Somit katalysieren NOX-Enzyme die Bildung wichtiger Effektoren der Immunantwort [7]. Verschiedene andere Enzyme können ebenfalls ROS produzieren, wie z. B. Cyclooxygenasen, Lipoxygenasen und Cytochrome P450 [2, 5].
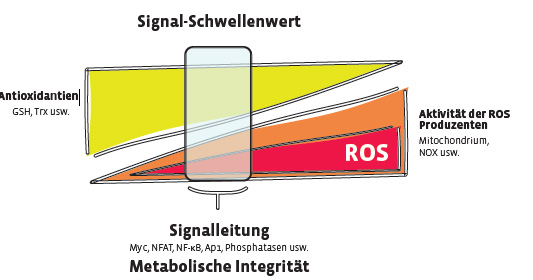
Die Kontrolle von ROS gewährleistet die zelluläre Funktion
Während hohe zelluläre ROS-Konzentrationen zytotoxisch wirken, sind niedrige und mittlere ROS-Konzentrationen an der Signalweiterleitung beteiligt. Hierbei nimmt H2O2 als stabilstes ROS-Molekül, welches frei durch Membranen diffundieren kann, eine besondere Funktion ein. In Proteinen kann H2O2 reversible posttranslationale Modifikationen durch die Oxidation freier Thiole einfügen. Dabei handelt es sich vornehmlich um die Oxidation der Sulfhydryl-Gruppen von Cysteinresten (Cys), wodurch Sulfonsäurereste (-SOH), Disulfidbindungen (-SS), Sulfonamidreste oder Glutathionylierungen (-SSG) entstehen können [7]. Diese Modifikationen können die Aktivität der betroffenen Signalmoleküle erheblich beeinflussen und spielen bei der Regulation von Kinasen, Transkriptionsfaktoren, Histon-Deacetylasen, antioxidativen Enzymen und Phosphatasen eine wichtige Rolle [2, 5, 7]. Beispielsweise kann im Fall der Serin-/Threonin-Phosphatasen das katalytische Cys durch ROS vorübergehend oxidiert werden, was zur Inaktivität des Enzyms führen kann. Entsprechend können zelluläre ROS-Konzentrationen einen zelltypspezifischen Signalleitungsschwellenwert definieren und somit die Stärke, aber auch die Richtung der Signalleitung beeinflussen (Abb. 1). Die Kontrolle von intrazellulärem ROS ist daher von fundamentaler Bedeutung für die zelluläre Funktion. Um dies zu gewährleisten, besitzen Zellen einen weitgefächerten antioxidativen Schutzmechanismus. Dieser wird hauptsächlich von NRF2, einem ROS-sensitiven Transkriptionsfaktor, kontrolliert [1, 2]. Steigt die ROS-Konzentration in der Zelle an, wird NRF2 aktiviert und initiiert die Expression von antioxidativen Molekülen, die der zellulären ROS-Anreicherung entgegenwirken. NRF2 kontrolliert verschiedene antioxidative Systeme wie z. B. die SODs, aber auch Peroxiredoxin (PRX), Thioredoxin (TRX), die Glutathion-Peroxidase (GPX) und die Synthese von Glutathion (GSH). Wie bereits angesprochen konvertieren SODs O2•‒ zu dem weniger reaktiven, aber stabileren H2O2. Anschließend wird H2O2 durch PRX/TRX und GPX/GSH zu H2O reduziert, wodurch der zellschädigenden Wirkung von H2O2 entgegen gewirkt wird [8]. Oxidierte Proteine können ebenfalls durch diesen Mechanismus wieder in den reduzierten Zustand überführt werden. Bei diesen Reaktionen handelt es sich um sog. Redoxreaktionen, bei denen PRX und GPX wechselseitig oxidieren, und durch TRX bzw. GSH wieder reduziert werden (Abb. 2). Letztendlich werden die antioxidativen PRX/TRX- und GPX/GSH-Systeme wieder durch NADPH regeneriert, welches durch unterschiedliche metabolische Prozesse gewonnen werden kann [8].