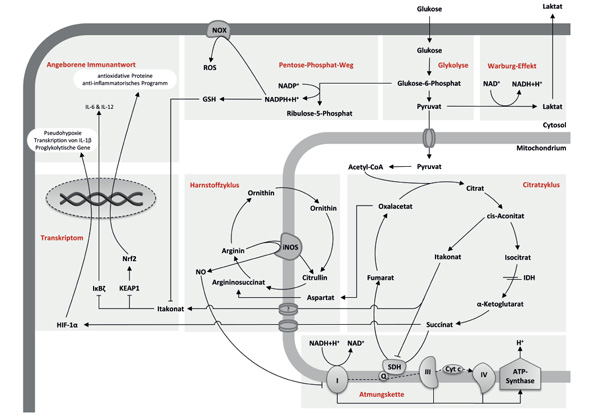
Die Immunantwort während einer Infektion wird nicht nur durch Zytokine und Chemokine gesteuert, sondern auch durch die Aktivität von metabolischen Stoffwechselwegen der Immunzellen. Makrophagen unterziehen sich dabei einer gravierenden metabolischen Umstrukturierung, weit über den bekannten Warburg-Effekt hinaus, wobei die Synthese und Wirkung von Itakonsäure eine Schlüsselrolle einnimmt.
Anfangs als antibakterielle Substanz klassifiziert ist heute bekannt, dass Itakonsäure auch einen regulatorischen Effekt auf den mitochondrialen Metabolismus hat. Durch Inhibierung der Succinatdehydrogenase (Komplex II) und der daraus resultierenden Succinatakkumulation führt Itakonsäure via Stabilisierung von HIF-1α zur Transkription von IL-1β und glykolytischen Genen. Neueste Studien zeigen, dass Itakonsäure zum einen die mitochondriale ROS- Produktion stimulieren als auch Glutathion alkylieren, und dabei sowohl eine Nrf2-abhängige und -unabhängige Immunantwort induzieren kann.
Schlüsselwörter: Itakonat, Immunmetabolismus, Makrophagen, Massenspektrometrie
Metabolische Reprogrammierung in Makrophagen
Die metabolische Reprogrammierung von Makrophagen während einer Immunreaktion ist bereits seit den 1970er-Jahren bekannt. Gordon C. Hard zeigte, dass aktivierte murine Makrophagen aerobe Glykolyse zur ATP-Generierung nutzen, bekannt als Warburg-Effekt. Zudem wurde ein verstärkter Pentose-Phosphat-Weg (PPP) in aktivierten murinen Makrophagen beschrieben. Der PPP ist der Hauptproduzent für NADPH zur Regenerierung (Reduktion) von oxidiertem Glutathion (GSSG) zu GSH [1]. Darüber hinaus können Makrophagen durch Regulation unterschiedlicher Isoformen der NADPH-Oxidase reaktive Sauerstoffspezies (ROS) produzieren [2]. Reaktive Stickstoffspezies (RNS) werden in Form von Stickoxid als Nebenprodukt bei der Synthese von Citrullin aus Arginin durch die Stickstoffmonoxid-Synthase (iNOS) im Harnstoffzyklus gebildet [1]. Die Hauptfunktion von ROS und RNS dient der Eliminierung von Pathogenen im Phagosom der Makrophagen [3]. Jedoch führt die vermehrte Bildung von Stickoxiden zur Nitrosylierung der Komplexe I und IV der Elektronentransportkette und inhibiert so die mitochondriale Atmung. Die Folge ist eine Verschiebung des Makrophagen-Metabolismus zu verstärkter Glykolyse, um ausreichend ATP zu produzieren [1]. Stickoxide inhibieren zudem alle Eisen-Schwefel-haltigen Enzyme, wie die Isocitratdehydrogenase (IDH), Aconitase und die Succinatdehydrogenase (SDH) aus dem Citratzyklus, deren Regulation maßgeblich an der immunologischen Antwort von pro-inflammatorischen Makrophagen beteiligt ist [4]. Die Herunterregulierung dieser Enzyme führt zur Unterbrechung des Citratzyklus. Die daraus folgende Citrat- und Isocitrat-Akkumulation, insbesondere durch die IDH-Inhibierung, dient dann als Vorläuferreservoir für die Itakonat-Synthese (Abb. 1) [5].
Über diese rein metabolischen Effekte hinaus wird die Polarisierung der Makrophagen auch maßgeblich durch den Transkriptionsfaktor „hypoxia inducible factor“ (HIF) reguliert. Dabei induziert die Untereinheit HIF-1α neben der Erhöhung der aeroben Glykolyse, der Polarisierung zu einem inflammatorischen Phänotyp sowie der Stickstoffmonoxid-Synthese, auch eine erhöhte Expression des Zytokins IL-1β, nicht aber TNFα. Dies stellt eine Besonderheit der Mitochondrien bei der Zytokinproduktion dar. Die Stabilisierung von HIF-1α wird durch Akkumulation von Succinat [6] und mitochondriale ROS (mROS) induziert [7]. Dieser Prozess wird als pseudohypoxischer Metabolismus bezeichnet und ist als Immunantwort in klassisch aktivierten Makrophagen zu beobachten (Abb. 1) [8]. Im Gegensatz dazu induziert HIF-2α die Ausbildung von anti-inflammatorischen Makrophagen, deren Harnstoffzyklus zur Bildung von Ornithin aus Arginin verschoben wird. Dies dient dann der Polyamin-Synthese und erfüllt Funktionen zur Regenerierung des geschädigten Gewebes. Alternativ aktivierte Makrophagen nutzen im Allgemeinen den oxidativen Metabolismus zur Energiegewinnung. So gewinnen sie Energieäquivalente aus der β-Oxidation und induzieren die Expression von Bestandteilen der Elektronentransportkette. Letzteres führt zur metabolischen Modulation in Richtung oxidativer Phosphorylierung bei moderater glykolytischer Aktivität und damit auch zu erhöhtem Einfluss von Pyruvat in den Citratzyklus [9].
Der Metabolismus LPS-aktivierter Makrophagen hängt demnach von aerober Glykolyse ab. Dies wird durch stabilisiertes HIF-1α, zur Generierung von IL-1β und Itakonat sowie der Transkription proglykolytischer Gene wie dem Glukosetransporter GLUT-1, der Laktat-Dehydrogenase A und der Hexakinase-2, verursacht [10].