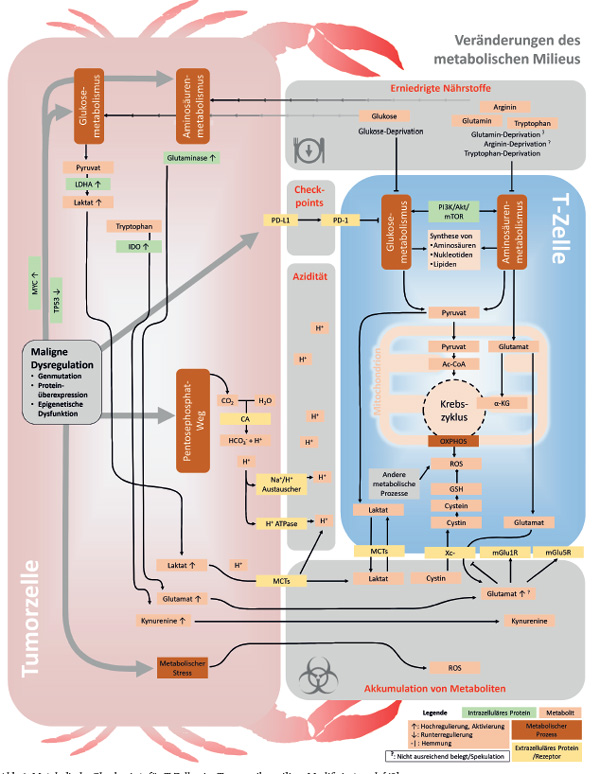
Der Metabolismus stellt die Grundlage für das Überleben, die Proliferation und Funktion einer Zelle dar. Mittlerweile ist klar, dass Stoffwechselwege aktiv spezifische zelluläre Funktionen regulieren und auch benachbarte Zellen beeinflussen können. Insbesondere Tumorzellen sind oft hochaktiv in der Aufnahme und im Stoffwechsel von Nährstoffen, aber auch in der Sekretion von metabolischen Endprodukten. Ein bekanntes Beispiel stellt die gesteigerte Aufnahme von Glukose sowie die Produktion von Laktat dar, wodurch einerseits das Tumorwachstum gefördert und andererseits Tumor-infiltrierende Immunzellen moduliert werden. In diesem Artikel sollen – neben dem Glukosestoffwechsel – sowohl ausgewählte Stoffwechselwege des Tumors und deren Auswirkungen auf das Immunsystem als auch die Implikationen für die Tumortherapie diskutiert werden.
Schlüsselwörter: Metabolismus, Immunzellen, T-Zellen, Checkpoint
Glykolyse und Laktatproduktion
Die maligne Transformation führt zu einem veränderten zellulären Glukose-Metabolismus. Hierbei nehmen Tumorzellen vermehrt Glukose auf und verstoffwechseln sie in mehreren Schritten zu Laktat. Dieses Phänomen wurde erstmals von Otto Warburg beschrieben, und ist daher unter dem Begriff
„Warburg-Effekt“ bekannt. Laktat wird im Ko-Transport mit Protonen ins Interstitium transportiert. Der Warburg-
Effekt hat zwei potentiell wichtige Implikationen für das Tumor-Mikromilieu (TME); zum einen kann die Glukosekonzentration stark abnehmen [1–3], und zum anderen kann es zu einer Laktat-Akkumulation sowie zu einem Ansäuern des TME kommen [4].
Niedrige Glukosekonzentrationen können Auswirkungen auf die Funktion von Immunzellen im TME haben. So zeigen verschiedene in vitro Studien, dass die Aktivierung von T-Zellen abhängig von der Glukosekonzentration ist [5]. Die genauen Grundlagen dieser Glukoseabhängigkeit sind nicht bekannt; es gibt jedoch Hinweise, dass sowohl translationale als auch epigenetische Regulationsmechanismen eine Rolle spielen und zur verminderten Expression bestimmter Effektor-Moleküle, wie z. B. des Zytokins Interferon-gamma, führen [6]. Die Relevanz dieser Beobachtungen für Tumoren ist jedoch weitgehend unklar. Zum einen sind humane Immunzellen, wie z. B. T-Zellen, robust und können sehr niedrige Glukosekonzentrationen tolerieren, wenn andere Nährstoffe ausreichend vorhanden sind [7, 8]. Zum anderen werden die meisten in vitro Studien mit supraphysiologischen Glukosekonzentrationen durchgeführt und sind somit nur begrenzt relevant für die in vivo Situation im Menschen. Auch ist die extrazelluläre Glukosekonzentration in humanen Tumoren nur unzureichend untersucht und ein Fokus gegenwärtiger Forschung. Zwar wurden in verschiedenen Tumorentitäten erniedrigte Glukosekonzentrationen gegenüber normalem Gewebe nachgewiesen, die kritische Grenze, unter welcher möglicherweise eine Immunzelldysfunktion auftritt, wurde aber meist nicht unterschritten [3, 9–11].
Obwohl die genauen Mechanismen unklar bleiben, gibt es viele Hinweise für negative Auswirkungen des verstärkten Glukose-Metabolismus von Tumoren auf Tumor-infiltrierende Immunzellen (Abb. 1). So konnten wir zeigen, dass eine verstärkte Expression des Glukosetransporters Glut1, der normalerweise mit einer erhöhten Glykolyse einhergeht, in Nierenzellkarzinomen mit einer erniedrigten T-Zell-Infiltration korreliert [12]. Ähnliche Beobachtungen wurden in Plattenepithelkarzinomen der Mundhöhle gemacht [13]. Darüber hinaus deuten aktuelle Arbeiten auf eine Rolle des Tumor-Glukosemetabolismus in der Resistenz gegenüber Tumor-Immuntherapien hin [14, 15].
Zusätzlich zu der möglichen Konkurrenz um Glukose und einem dadurch auftretenden Substratmangel, könnten Tumorzellen über den therapeutisch relevanten PD-1-/PD-L1-Signalweg den Metabolismus der Tumor-infiltrierenden Immunzellen beeinflussen. Patsoukis und Kollegen konnten zeigen, dass eine Ligation von PD-1 auf T-Zellen zu einer Beeinträchtigung von Glukoseaufnahme und Glykolyse von T-Zellen führt [16]. Da der Ligand (PD-L1) auf vielen Tumorzellen exprimiert wird, könnten auf diesem Weg Tumorzellen den Immunzellmetabolismus modulieren. Entsprechend zeigen unsere eigenen Analysen in humanen Nierenzellkarzinomen, dass Tumor-infiltrierende, PD-1-exprimierende CD8-T-Zellen glykolytisch vermindert aktiv waren, wobei keine erniedrigte Glukosekonzentration im Tumor feststellbar war [17]. Einen ähnlichen metabolischen Defekt konnten wir auch in CD8-T-Zellen in humanen Melanomen [18] und bei B-Zell-Leukämie [19] nachweisen.
Die verstärkte Glykolyse der Tumorzellen führt in vielen Tumoren auch zu einer Akkumulation von Laktat und Protonen (Milchsäure). Die intratumorale Laktatkonzentration kann bis zu 40 mM betragen [9], und hohe Laktatspiegel korrelieren mit einer schlechten Prognose der Tumorpatienten [9, 10]. Wie wir und andere zeigen konnten, hat Laktat bzw. Milchsäure inhibitorische Wirkungen auf Immunzellen. Laktat hemmt die Proliferation und Aktivierung von CD8-T-Zellen und NK-Zellen [20]. Hierbei kommt es u. a. zu einer reduzierten Expression des Transkriptionsfaktors NFAT, wodurch die T-Zell-Aktivität abgeschwächt wird [9, 21]. Hand in Hand mit der Laktat-Akkumulation geht eine Azidifizierung des TME (Abb. 1). Es konnte gezeigt werden, dass ein niedriger pH die Zytokinproduktion von T-Zellen inhibiert. Als möglicher Mechanismus dieser Effekte wird die Dysregulation der STAT5-, ERK-, AKT- und p38-Signalwege diskutiert [22]. Dementsprechend konnte eine Pufferung des niedrigen pH durch Bikarbonat die T-Zell-Infiltration von Tumoren erhöhen und die Effekte einer Anti-Tumor-Immuntherapie in präklinischen Studien verstärken [23].
Metabolismus von Aminosäuren
Neben dem verstärkten Glukose-Stoffwechsel weisen viele Tumorzellen eine verstärkte Aufnahme und Metabolismus von Aminosäuren auf. Ein Beispiel ist der mittlerweile ausführlich untersuchte Tryptophan-Metabolismus von Tumorzellen. Das Enzym Indolamin-2,3-Dioxygenase (IDO), ursprünglich in der Plazenta als ein immunsupprimierender Faktor beschrieben, katalysiert den Abbau von Tryptophan zu Kynurenin. Eine erhöhte Expression von IDO wurde mittlerweile in vielen Tumorentitäten beschrieben [24]. Ein gesteigerter Tumor-Tryptophan-
Metabolismus durch die überexprimierte IDO kann die lokale Tryptophan-Konzentration erniedrigen. Es konnte gezeigt werden, dass aktivierte Effektor-T-Zellen unter Tryptophan-„Entzug“ leiden und eine verminderte Proliferation zeigen [24]. Einen der möglichen Mechanismen stellt die durch Tryptophan-Mangel induzierte, GCN2-Kinase-abhängige Runterregulation der T-Zell-Rezeptor ζ-Kette dar [25]. Fehlendes extrazelluläres Tryptophan könnte somit die Anti-Tumor-Immunität beeinträchtigen. Im Einklang mit dieser Hypothese konnte eine erhöhte IDO-Expression mit einem schlechten Überleben von Tumorpatienten korreliert werden [26]. Zusätzlich zu einer verminderten Tryptophan-Konzentration führt die IDO-Aktivität der Tumorzellen zur Produktion von Kynureninen [27]. Diese Metaboliten werden z. T. als immunsuppressiv beschrieben und konnten in einzelnen Arbeiten regulatorische T-Zellen induzieren [28].
Glutamin ist essentiell für Proliferation und Funktion von verschiedenen Immunzellen [29]. Von allen Aminosäuren hat Glutamin die höchste Konzentration im Blut und ist wichtig für viele Stoffwechselwege wie den Krebszyklus, die Synthese von Nukleotiden oder den Glutathion-Stoffwechsel, und somit für die Redoxbilanz der Zelle. Niedrige Glutaminkonzentrationen oder die Inhibition von Enzymen, die Glutamin transportieren oder verstoffwechseln, wirken anti-inflammatorisch [30]. Viele Tumoren überexprimieren Glutaminase oder tragen eine Myc-Mutation, wodurch es zu einer erhöhten Aufnahme und Verstoffwechselung von Glutamin kommt [31]. Es ist jedoch zurzeit unklar, ob im TME eine erniedrigte Glutamin-Konzentration vorliegt und ein Glutamin-Entzug durch Tumorzellen die Anti-Tumor-Immunität beeinträchtigen kann. Analog zum Glukose-Metabolismus, wo ein erhöhter Metabolismus mit einer hohen Laktatproduktion korreliert, kann ein gesteigerter Glutamin-Metabolismus zur Glutamat-Akkumulation führen (Abb. 1). Tatsächlich konnten Briggs et al. eine erhöhte Produktion von Glutamat durch Brustkrebszellen nachweisen, wobei Glutamat parakrin das Tumorwachstum fördert [32]. Die Effekte von Glutamat auf Immunzellen sind weitgehend unbekannt. T-Zellen exprimieren jedoch Glutamatrezeptoren, deren Aktivierung die Funktion der T-Zelle und somit die Anti-Tumor-Aktivität beeinflussen kann [33, 34]. Unabhängig von Glutamatrezeptoren könnte auch die Aktivität von Cystein/Glutamat-Antiportern (xCT) und somit die Redoxbilanz der Immunzelle gestört werden [35].