Bei Versagen der Erstlinientherapie werden in der AWMF-Leitlinie „Kolorektales Karzinom“ Checkpoint-Inhibitoren als potentielle Behandlung bei Mikrosatelliten-instabilen Tumoren (MSI) erwähnt. In Deutschland ist diese Immuntherapie noch nicht zugelassen. Unter bestimmten Voraussetzungen könnte sie auch bei Mikrosatelliten-stabilen Tumoren (MSS) eingesetzt werden.
Schlüsselwörter: Mikrosatelliten-Instabilität, PD-L1, POLE-Mutation
Die Immuntherapie mit den sogenannten Immun-Checkpoint-Inhibitoren ist für einige Krebserkrankungen inzwischen schon zum Standard geworden. Die bisher verwendeten Antikörper aus dieser Gruppe wirken, indem sie natürliche „Bremsen, also negative Rückkopplungsmechanismen, im Immunsystem aushebeln. Antikörper gegen CTLA-4 („anti-cytotoxic T-lymphocyte antigen-4“, z. B. Ipilimumab) wirken dabei in frühen Stadien der T-Zell-Aktivierung in den Lymphknoten, Antikörper gegen PD-1 („anti-programmed death-1“, z. B. Pembrolizumab, Nivolumab) oder PD-L1 („PD-ligand 1“, z. B. Atezolizumab) dagegen in späteren Stadien in der Peripherie. Gemeinsam ist beiden Strategien, dass letztendlich mehr aktive zytotoxische T-Zellen für die Bekämpfung des Tumors zur Verfügung stehen [1].
Für Darmkrebs ist in Europa nach wie vor noch kein Medikament aus dieser Gruppe zugelassen. In den USA ist das anders: Dort kann die Untergruppe der Patienten mit fortgeschrittenem, Mikrosatelliten-instabilem (MSI-high, MSI-H) bzw. Mismatch-Repair-defizientem (dMMR) Darmkrebs mit Pembrolizumab, Nivolumab oder einer Kombination von Nivolumab und Ipilimumab behandelt werden. Das sind etwa 5% aller Patienten mit kolorektalen Karzinomen (KRK) im metastasierten Stadium. Immun-Checkpoint-Inhibitoren werden auch jetzt schon in der aktuellen deutschen S3-Leitlinie „Kolorektales Karzinom“ [2] in späteren Therapielinien als Option genannt.
Mikrosatelliten-Instabilität
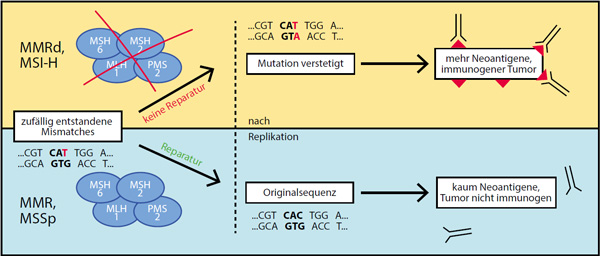
Bisher ist nur bei Mikrosatelliten-instabilen bzw. Mismatch-Repair-defizienten kolorektalen Karzinomen ein gutes Ansprechen auf eine alleinige Therapie mit Immun-Checkpoint-Inhibitoren beobachtet worden. Man nimmt an, dass das gute Ansprechen der MSI-H-Tumoren mit ihrer hohen Mutationslast (tumor mutational burden, TMB), also der Anzahl von Mutationen pro Megabasenpaar (Mbp) im Erbgut der Zelle, zusammenhängt. Als Mikrosatelliten-Instabilität bezeichnet man eine Längenveränderung kurzer repetitiver DNA-Abschnitte, der Mikrosatelliten. Sie ist Folge einer Mismatch-Repair-Defizienz, also des Verlusts der Fähigkeit, Basen-Fehlpaarungen (Mismatches) in der DNA zu korrigieren. Dadurch entstehen viele kleine Mutationen (z. B. Gewinne oder Verluste einzelner Basen). Liegen diese in kodierenden Regionen, entstehen in der Folge vermehrt veränderte Genprodukte, beispielsweise Proteine. Diese sogenannten Neoantigene können vom Immunsystem als Angriffspunkte gegen die Krebszellen genutzt werden. Insgesamt haben in den letzten Jahren Studien ergeben, dass Immuntherapien sehr viel besser gegen Tumoren wirken, die viele Mutationen aufweisen – wie das maligne Melanom oder der Tabak-assoziierte Lungenkrebs (Abb. 1) [3].
Erbliche Mutationen in Genen, die für Komponenten des Mismatch-Reparatur-Systems kodieren, liegen dem Lynch-Syndrom (HNPCC) zugrunde. Darmkrebs von Patienten mit Lynch-Syndrom ist daher üblicherweise Mikrosatelliten-instabil und damit ein mögliches Ziel für eine Immuntherapie. Wenn sporadische kolorektale Karzinome Mikrosatelliten-instabil sind, geht dieser Phänotyp meist auf die Hypermethylierung des MLH1-Gens zurück.
Ein Test auf Mikrosatelliten-Instabilität kann durch PCR-Analysen erfolgen, z. B. mithilfe des Bethesda-Panels. Auch ein per Immunhistochemie nachgewiesener Expressionsverlust der Reparatur-Proteine MSH2, MLH1, MSH6 und PMS2 kann eine Mismatch-Reparatur-Defizienz belegen [4]. Die Mutationslast im Tumor kann auch direkt durch Sequenzierung bestimmt werden. Hierzu sind mehrere Assays in der Entwicklung [5].