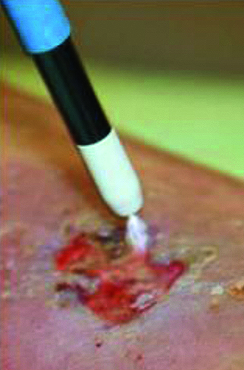
Kaltes Plasma erreicht die feinsten Nischen
Physikalische Behandlung chronischer Wunden
Bei chronischen Wunden sind physikalische Behandlungsverfahren eine attraktive Alternative zu Antibiotika und Antiseptika. Erste Erfolge mit kaltem Plasma lassen auf eine schonende und trotzdem effektive Keimabtötung hoffen.
Bei der antimikrobiellen Behandlung chronischer Wunden gewinnen neben chemischen auch physikalische Verfahren zunehmend an Bedeutung. Zu nennen sind hier die Elektrostimulation (ES), die extrakorporale Stoßwellentherapie (ESWT), die Low-Level-Laser-Therapie (LLLT), die Behandlung mit wassergefiltertem Infrarot A (wIRA) und – erst seit wenigen Jahren in der Anwendung – die Behandlung mit Kaltplasma, die im Folgenden näher beschrieben werden soll[1].
In der Physik stellt Plasma neben fest, flüssig und gasförmig einen vierten Aggregatzustand der Materie dar. Es entsteht beispielsweise in Blitzen oder Nordlichtern, wenn Elektronen unter hoher Energiezufuhr aus dem Atom- oder Molekülverbund herausgelöst, also ionisiert, werden. Typischerweise erhält man dabei heiße Plasmen mit Temperaturen von mehreren 10.000 °C; dosiert man die Energiezufuhr aber gerade so, dass die Ionisierung eben nur einsetzt, dann resultiert kaltes Plasma im Bereich der Körpertemperatur.
Unterschiedliche Prinzipien
Zurzeit stehen in Deutschland drei unterschiedliche Applikationssysteme für Kaltplasma zur Verfügung: Bei den gasbetriebenen Geräten hat sich das relativ inerte Edelgas Argon bewährt, wobei die reaktiven Moleküle gezielt auf die zu behandelnde Wunde geblasen werden. DBD-Plasmen (dielectric barrier discharge) arbeiten ohne Gas, nutzen dafür aber das Behandlungsareal als Gegenelektrode, sodass ein minimaler Stromfluss zu spüren ist. Die dritte Methode erzeugt das Plasma im geschlossenen Glaskolben und benötigt ebenfalls den Körper als Gegenelektrode. Allen Verfahren gemeinsam ist, dass die Plasmastrahlung in die feinsten Nischen der Haut eindringt und die Erreger somit auch an Rückzugsorten, die von gängigen Antibiotika und Antiseptika nicht erreicht werden (beispielsweise Haarfollikel), bekämpft werden können[2].
Wirkungsmechanismen
Zu den bioaktiven Komponenten des Kaltplasmas gehören auch diverse geladene Partikel wie reaktiver Sauerstoff und Stickstoff, ultraviolette Strahlung, elektrische Felder, freie Radikale und Elektronen. Diese Mischung tötet die verschiedensten mikrobiellen Erreger, multiresistente Bakterien, Sporen, Viren, Pilze und Parasiten, innerhalb so kurzer Zeit ab, dass das Verfahren für den Menschen nicht schädlich ist. Um den Effekt in Zahlen zu fassen: Mit einer „Plasma-Taschenlampe“ (Argongas, 6 Elektroden, 110 W Mikrowellenausgangsleistung) wird die Keimzahl auf einer Agarplatte innerhalb von zwei Minuten um sechs log-Stufen reduziert[3]. Kaltplasma tötet sogar Mikroorganismen ab, die durch ihre Organisation in Biofilmen Resistenzen gegen Antibiotika entwickelt haben.
In vivo werden dem Kaltplasma zusätzliche günstige Wirkungen wie etwa Gefäßerweiterung und Normalisierung der Mikrozirkulation zugesprochen, und durch Induktion von Cytokinen und Wachstumsfaktoren kommt es zu einer Verbesserung der Nervenleitung, Stimulation von Fibroblasten und Neubildung von Gefäßen. All dies kann zur Wundheilung beitragen.
Der größte Vorteil besteht sicher darin, dass der Wirkmechanismus unabhängig von den bekannten Resistenzmechanismen gegen Antibiotika ist. Allerdings findet man Unterschiede in der Empfindlichkeit von gramnegativen und grampositiven Erregern sowie solchen mit und ohne genetisch bedingter Oxacillin-Resistenz[1]. So variieren die benötigten Einwirkzeiten beispielsweise zwischen ca. 5 Sek. für planktonische und bis zu 20 Sek. für im Biofilm organisierte Mikroorganismen.
Dr. Gabriele Egert
Mitglied der Redaktion