Spezifisch, effizient, universell einsetzbar
Massenspektrometrie in der medizinischen Diagnostik
Die Massenspektrometrie entwickelt sich zunehmend zum Standardwerkzeug der Laboratoriumsmedizin. Möglicherweise wird sie die Immunchemie eines Tages in vielen Bereichen ablösen.
Die Massenspektrometrie-basierte Analytik ist schon heute aus dem labordiagnostischen Alltag nicht mehr wegzudenken und wird absehbar eine immer größere Bedeutung in vielen Bereichen der Labormedizin erlangen. Das Messprinzip beruht auf der Bestimmung von Molekülmassen, welche aufgrund der elementaren Zusammensetzung bereits eine charakteristische Substanzinformation beinhaltet.
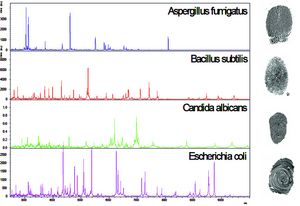
Wenn beispielsweise eine Bakterienkultur mittels MALDI-TOF MS untersucht wird, ergibt sich ein Spektrum unterschiedlicher Peptide, welche in ihrer Kombination charakteristisch sind für ein bestimmtes Bakterium. Auf der Basis einer solchen einfachen Mustererkennung können heute bereits routinemäßig Bakterien nach kultureller Anzucht sehr schnell und sicher identifiziert werden.
Neben einem Massenspektrometer ist allerdings auch die Verfügbarkeit einer entsprechenden Datenbank erforderlich, in der die Spektren von gut charakterisierten Referenzkeimen hinterlegt sind. Das Spektrum eines unbekannten Keimes wird dann über einen bioinformatischen Algorithmus mit der Datenbank abgeglichen; die Identifikation gelingt umso sicherer, je höher der Übereinstimmungsgrad mit einem Referenzspektrum ist. Die Vorgehensweise hat große Analogie mit dem kriminalistischen Abgleich von Fingerabdrücken und man spricht daher auch von einem „Peptid-Fingerprint“ (Abbildung 1).
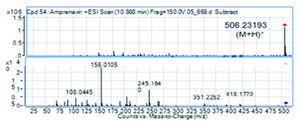
Schwieriger ist der Nachweis von einzelnen Molekülen wie etwa Medikamenten in einer komplexen Serumprobe. Zwar besitzen auch Medikamente aufgrund ihrer Summenformel ein definiertes Molekulargewicht, aber die Wahrscheinlichkeit für das Vorhandensein von Molekülen mit sehr ähnlicher oder sogar gleicher Masse (isobare Moleküle) in einer komplexen Matrix wie Serum, Plasma oder Urin ist sehr hoch. Um die Spezifität zu erhöhen, kann die Massenspektrometrie (MS) mit einem chromatografischen Trennverfahren kombiniert werden. Häufig wird hierzu die Liquid Chromatography (LC) gewählt, da sie eine direkte Kopplung von LC und MS ermöglicht. Des Weiteren können die Moleküle im Massenspektrometer fragmentiert und auf diese Weise detaillierter untersucht werden. Da die kovalenten Bindungen innerhalb eines Moleküls unterschiedliche Festigkeiten haben, zerbricht die Muttermasse bei definierter Energiezufuhr in vorhersagbare Tochtermoleküle. Dieses Fragmentspektrum ist neben Retentionszeit und Muttermasse ein Stoffcharakteristikum, das die eindeutige Identifikation einer Substanz erlaubt.
Medikamente und Gifte
Nach Kalibration und unter Verwendung von internen Standards ist zudem auch einen Quantifizierung der Analytkonzentration möglich. Die am häufigsten verwendete Gerätekonfiguration für die Quantifizierung kleiner Moleküle ist die LC-MS/MS (Abbildung 2). Als Massenspektrometer wird hierfür typischerweise ein Triple-Quadrupol MS eingesetzt. Im ersten Quadrupol wird die Muttermasse selektioniert, welche in dem zweiten Quadrupol durch Energiezufuhr fragmentiert wird. Das Fragmentspektrum wird schließlich in dem dritten Quadrupol aufgezeichnet. Die Kombination aus Massenspektrometrie der Muttermasse und der Fragmentmasse wird auch als Tandem-Massenspektrometrie (MS/MS) bezeichnet.
Typischerweise wird mittels LC-MS/MS heute schon das therapeutische Drug Monitoring (TDM) für zahlreiche Medikamente wie etwa Immunsuppressiva, Tyrosinkinaseinhibitoren, Neuroleptika oder Antibiotika durchgeführt, für die es keinen bzw. nur kostspielige immunologische Testverfahren gibt. Zudem kann die Massenspektrometrie zwischen aktiver Muttersubstanz und inaktiven Metaboliten unterscheiden, was aufgrund der hohen Kreuzreaktivität von immunologischen Tests in der Regel nicht möglich ist. Folglich haben MS-basierte Detektionsmethoden schon immer eine Rolle bei pharmakokinetischen Studien gespielt. Durch zunehmenden Bedienerkomfort der LC/MS-Geräteplattformen sowie durch steigenden Automatisationsgrad dringt die LC/MS aber aus Forschungsapplikationen nun zunehmend auch in klinisch-diagnostische Anwendungen vor.
So ist die LC-MS-Methodik beispielsweise in der klinischen Toxikologie auf dem Vormarsch. Hier können insbesondere neuere Designerdrogen, die mit immunologischen Testmethoden nicht zu detektieren sind, zeitnah und sicher erkannt werden. Voraussetzung ist lediglich die Verfügbarkeit der Reinsubstanz, von der ein Referenzspektrum erstellt wird; dieses muss in einer Datenbank abgelegt werden. Erste kommerzielle Systeme bieten Datenbanken mit mehr als 800 medizinisch-toxikologisch relevanten Substanzen an.
Der LC/MS-Workflow ermöglicht zudem eine kurze Durchlaufzeit, sodass die Vergiftungsanalytik in entsprechender Tiefe auch im Rahmen einer Notfallversorgung angeboten werden kann, wie es vergleichbar bisher nur im Rahmen von forensischer Analytik möglich war. Im Gegensatz dazu verlieren immunologische Testsysteme in der Toxikologie zunehmend an Bedeutung, da die Generierung von diagnostischen Antikörpern für Designerdrogen bzw. neue Medikamentengruppen in der Entwicklung aufwendig, langwierig und somit sehr teuer ist. Zusätzlich sind Immunoassay-Ergebnisse in der Toxikologie aufgrund der Kreuzreaktivität der Antikörper mit erheblichen Unsicherheiten behaftet, sodass im Zweifelsfall ohnehin eine MS-basierte Bestätigungsanalytik etwa für gutachterliche Zwecke erforderlich ist.
Neugeborenen-Screening
Auch weitere niedermolekulare Substanzklassen wie etwa Aminosäuren und Stoffwechselprodukte können mittels LC-MS/MS sehr effizient und im Multiplex-Format analysiert werden. Aufgrund ihrer Leistungsfähigkeit hat sich die massenspektrometrische Analytik deshalb zur Diagnostik von Stoffwechseldefekten im Rahmen des Neugeborenenscreenings (NGS) schon lange fest etabliert.
Ein Paradebeispiel ist die Phenylketonurie, bei der aufgrund eines angeborenen Enzymdefektes die Umwandlung von Phenylalanin (Phe) in Tyrosin (Tyr) gestört ist. In der Folge kommt es zu einer Akkumulation von Phenylalanin (Substratstau) und zu einem Mangel an Tyrosin. Mithilfe der Massenspektrometrie kann die Konzentration von Phenylalanin und Tyrosin im Blut von Neugeborenen sicher quantifiziert werden. Der in den Anfängen des NGS durchgeführte funktionelle Guthrie-Test, der auf dem Phenylalanin-abhängigen Wachstum von Bakterienkulturen beruhte, ist damit heute obsolet.
Weitere Stoffwechselstörungen wie etwa die Ahornsirupkrankheit oder der Medium-Chain-Acyl-Coenzym-A-Dehydrogenase (MCAD)-Mangel werden heute ebenfalls sehr effizient mittels LC/MS erfasst, und auch das adrenogenitale Syndrom ist heute Teil des LC/MS-basierten NGS. Darüber hinaus lassen sich zahlreiche weitere Endokrinopathien aufgrund der LC/MS Multiplex-Kapazität heute sehr effizient diagnostizieren. Hierfür stehen mittlerweile kommerzielle Testsysteme für die simultane Identifikation und Quantifizierung von Steroidhormonen aus Blutproben zur Verfügung.
Zukunftsfeld Proteomics
Durch die technische Weiterentwicklung der Massenspektrometrie sind mittlerweile auch robuste Methoden der Proteinquantifizierung aus Blutproben verfügbar. Dabei werden nach tryptischem Verdau der klinischen Proben gezielt proteotypische Peptide durch Kombination von Flüssigchromatografie und Tandem-Massenspektrometrie (LC-MS/MS) analysiert. Durch Zugabe eines isotopenmarkierten internen Standards ist eine absolute Quantifizierung der Spaltstücke und damit der Proteine, aus denen sie in äquimolarer Konzentration durch den tryptischen Verdau freigesetzt worden sind, möglich. Schon heute können so Hunderte Proteine einer Serumprobe gleichzeitig quantifiziert werden.
Diese ungeheure Multiplex-Kapazität wird für die Labordiagnostik zukünftig ein enormes Potenzial entfalten. Nicht nur die Zahl der zu quantifizierenden Proteine aus klinischem Material wird sprunghaft ansteigen. Auch posttranslationale Modifikationen (PTMs) wie beispielsweise proteolytische Prozessierungen, Phosphorylierungen, Acetylierungen oder Glykosylierungen können durch MS-basierte Methoden dargestellt werden. Im Gegensatz dazu bieten immunologische Testverfahren in der Regel keine Möglichkeit, Trunkierungen oder andere PTMs sicher zu erfassen; biochemisch sind solche Modifikationen durchaus entscheidend, etwa für den Aktivierungszustand des jeweiligen Proteins.
Ein großer Vorteil der Immunoassays ist nach wie vor deren deutlich höhere analytische Sensitivität im Vergleich zu MS-basierten Testverfahren. Allerdings kann die analytische Sensitivität bei Plasmaproben entweder durch Anreicherung von Zielproteinen oder durch Depletion hochabundanter Proteine soweit verbessert werden, dass die LOQ-Grenze im unteren ng/ml-Bereich liegt.
Ein Beispiel für die erfolgreiche, routinetaugliche Etablierung einer MS-basierten Proteinanalytik ist die Quantifizierung von Thyreoglobulin durch die Mayo Klinik. Der immunologische Assay ist aufgrund der Heterogenität der im Einsatz befindlichen diagnostischen Antikörper nur schlecht standardisierbar, was sich in einer breiten Streuung der Ringversuchsergebnisse widerspiegelt. Auch Interferenzen mit Anti-Thyreoglobulin-Antikörpern sind für die immunologische Quantifizierung ein großes Problem, nicht jedoch für die MS.
Ausblick
Das Potenzial der Massenspektrometrie im Bereich der Proteinquantifizierung wurde mittlerweile von verschiedenen Fachgesellschaften erkannt. So hat die IFCC eine Arbeitsgruppe zu diesem Thema gegründet, und auch die DGKL fördert aktuell ein Projekt, bei dem es um die Etablierung von Referenzmethoden für die Proteinquantifizierung geht. Zudem wurden kürzlich in einer Expertenrunde Leitlinien erarbeitet, die bei der Einführung der MS-basierten Proteinquantifizierung für diagnostische Zwecke zu beachten sind. So werden hohe Richtigkeit, Präzision sowie die Entwicklung von Qualitäts-Sicherungsmaßnahmen wichtige Bausteine für die fortschreitende Etablierung von MS-basierten Assays in der medizinisch-diagnostischen Routineanalytik sein.
Ein Durchbruch auf breiter Front kann aber nur gelingen, wenn der Probendurchsatz sich durch weitere Automation deutlich steigern lässt und die LC-MS-Plattformen wie andere Analyzer auch an eine Probenverteilstraße angeschlossen werden können. Hier ist die Industrie gefordert.
Bis es soweit ist, liegt es an den Anwendern, den Stellenwert der LC/MS-basierten Analytik vor allem in Spezialbereichen der Labordiagnostik weiter auszubauen. Insbesondere gilt es, die erdrückende Fülle an neuen, quantifizierbaren Biomarkern nach diagnostischer Relevanz zu kategorisieren und ihren Mehrwert über die klinische Evidenz zu definieren.

Prof. Dr. Peter Findeisen
MVZ Labor Dr. Limbach und Kollegen GbR
peter.findeisen[at]labor-limbach[dot]de
Weitere Informationen zur Massenspektrometrie
Einen separaten Fachartikel über den Einsatz der MALDI-TOF-Technik in der Mikrobiologie von Priv.-Doz. Dr. B. Ghebremedhin finden Sie auf S. 130–131. Dort stellt bioMérieux den neuen Vitek MS mit einer umfangreichen, intelligenten Datenbank zur Keimidentifizierung vor (S. 131).
Agena Bioscience setzt diese Technik für die molekulare Blutgruppenbestimmung ein .
Das Unternehmen Chromsystems Instruments & Chemicals hat sich auf Verbrauchsmaterialien (Kits, Kalibratoren, Kontrollen etc.) sowie Serviceleistungen für diagnostische Applikationen spezialisiert (S. 113/115).
gh