Von Gerinnungs- und Rheumafaktoren
Labortests für die Thrombophiliediagnostik
Eine Thromboseneigung kann vielfältige angeborene und erworbene Ursachen haben. Für deren Diagnostik steht ein breites methodisches Arsenal – von Gerinnungstests und immunchemische Bestimmungen bis zur Molekularbiologie – zur Verfügung.
Etwa einer von tausend Deutschen erleidet im Laufe eines Jahres eine Thrombose, also den Verschluss eines Blutgefäßes durch einen Thrombus. Das Risiko steigt stark mit dem Alter sowie nach operativen Eingriffen. Im Krankenhaus sind Thrombosen eine häufige Komplikation (Innere Medizin 10–20%, Allgemeinchirurgie 15–40%, orthopädische Chirurgie 40–60%). Das treibt die Verweildauer und die Kosten in die Höhe.
Thrombotische Gefäßverschlüsse betreffen sowohl Arterien als auch Venen. Venöse Thromboembolien (VTE) treten am häufigsten in den Beinen und im Becken auf. Eine Ablösung von Thrombusmaterial kann in räumlich entfernten Gefäßen neue Verschlüsse verursachen. So ist eine Lungenembolie oft die Folge einer Beinvenenthrombose, während der Embolus beim ischämischen Schlaganfall typischerweise aus dem Herzen stammt.
Patienten mit thromboembolischen (TE) Erkrankungen haben ein hohes Risiko für Rückfälle. Daher ist eine medikamentöse, manchmal lebenslange Thromboseprophylaxe für eine steigende Zahl von Patienten unabdingbar, um VTE, ein postthrombotisches Syndrom oder ischämische Verschlüsse im Bereich von Herz oder Gehirn zu verhindern.
Der Begriff „Thrombophilie“ kennzeichnet Patienten, die aufgrund genetischer oder erworbener Ursachen häufiger – oft schon in relativ jungem Alter – Thrombosen entwickeln. Indirekte Zeichen einer Thrombophilie können auch Aborte und Schwangerschaftskomplikationen sein. Neben schicksalhaften Ursachen, wie angeborenen und erworbenen Mutationen, Alter oder Bettlägerigkeit nach chirurgischen Eingriffen, gibt es vermeidbare Auslöser, insbesondere Rauchen, Übergewicht und Bewegungsmangel. Selten löst ein einzelner Risikofaktor eine VTE aus, doch in Kombination potenzieren sich die Risiken.
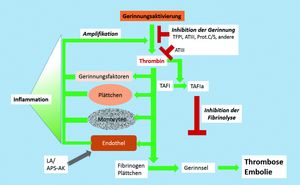
Pathogenese
Ursachen für Thrombosen sind gemäß der sog. Virchow‘schen Trias veränderte Eigenschaften von Blut, Gefäßwand oder Blutströmung. Der Bildung einer Thrombose geht eine komplizierte Interaktion von Plasmaproteinen, Thrombozyten, Monozyten und der Gefäßwand voraus. Die Schlüsselreaktion ist dabei eine erhöhte Thrombinbildung, die durch eine geringere Effizienz von Kontrollmechanismen, hohe Spiegel bestimmter Gerinnungsfaktoren, Vorliegen von Autoantikörpern, eine überschießende Entzündungsreaktion und andere Trigger ausgelöst werden kann. In der Folge kommt es zur Thrombozytenadhäsion und -aggregation, zur Bildung von Aggregaten aus Thrombozyten und Monozyten, und – insbesondere im venösen Abflussgebiet – zur Bildung von Fibringerinnseln. Plasmin und andere Proteasen wie Elastase aus Monozyten oder die Matrixmetalloprotease MMP-9 können schließlich Teile des Thrombus abspalten und so die Bildung von Embolien auslösen.
Regulationsmechanismen
Auf der Innenseite der Gefäßwand regulieren Endothelzellen die Thrombinbildung und hemmen die Plättchenaktivierung. Verschiedene Proteaseinhibitoren im Blut, insbesondere Tissue Factor Pathway Inhibitor (TFPI) und Antithrombin (ATIII), kontrollieren einige der aktivierten Gerinnungsfaktoren, andere wie Plasminogen-Aktivator-Inhibitor 1 (PAI-1) hemmen Fibrinolyseproteasen. Eine Vielzahl weiterer Faktoren, Kofaktoren und Inhibitoren ist in die Entstehung bzw. Verhinderung von Thrombosen und Embolien involviert, zum Beispiel Protein C und sein Kofaktor Protein S als Inhibitoren von Gerinnungs- und Entzündungsvorgängen, endotheliales Heparansulfat als Kofaktor von ATIII oder Thrombomodulin als indirekter Protein-C-Aktivator.
Diagnostik
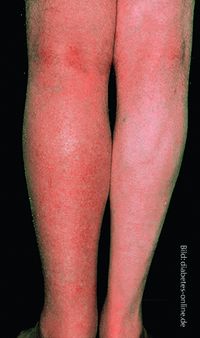
Klinische und anamnestische Zeichen einer tiefen Venenthrombose (sog. Wells-Score) sind Schwellung (Bild), eindrückbares Ödem, Schmerz und Verhärtung entlang der Vene, Kollateralvenen sowie Immobilisation, aktive Krebserkrankung und frühere Thrombosen. Diagnostisch wegweisend ist vor allem die Kompressionssonografie.
Aus der Virchowschen Trias ist nur das Blut der Labordiagnostik zugänglich. Da daraus meist auch nur Plasma untersucht wird, bleiben Effekte der Strömung, Endothelschäden etc. unberücksichtigt. Für die Thrombophiliediagnostik steht dennoch ein breites Methodenspektrum zur Verfügung (s. Tabelle), das über das klassische Gerinnungslabor deutlich hinausgeht. Globaltests (TPZ, aPTT) können eine verstärkte Thrombinbildung nicht erkennen, da sie die entscheidenden Regulationsmechanismen nicht abbilden. Besser geeignet sind Thrombingenerierungstests wie CAT (Calibrated Automated Thrombinography). Diese Methode ist auch im plättchenreichen Plasma einsetzbar, sodass einige von Thrombozyten vermittelte Reaktionen in das Ergebnis eingehen. Eine CAT-Variante, in der auch das Protein-C-System mit einbezogen wird, kann die verstärkte Thromboseneigung von bestimmten Antikontrazeptiva erkennen.
In manchen Fällen zeigen Patienten mit Thrombophilie laborchemisch nachweisbare Marker einer Hyperkoagulabilität wie z. B. erhöhte Werte von D-Dimer (Spaltprodukt aus Fibrin) oder dem Prothrombinaktivierungspeptid F1+2. Aber auch bei anderen Erkrankungen wie etwa bei Tumoren findet man erhöhte Konzentrationen solcher Aktivierungsmarker. Sie sind daher nicht sonderlich spezifisch, eignen sich wegen ihrer Sensitivität aber zum Ausschluss einer Thrombose oder Lungenembolie. So lassen sich andere, meist wesentlich teurere Untersuchungen einsparen und Patienten stratifizieren (Entlassung, Normalstation, Intensivmedizin). Am besten untersucht ist in diesem Zusammenhang D-Dimer. Zu Forschungszwecken werden auch thrombogene Mikropartikel oder Thrombozyten-Monozyten-Aggregate gemessen.
Angeborene Ursachen
Die in Europa, Nordafrika und Mittlerem Osten häufigste genetische Ursache einer Thrombophilie ist die sogenannte APC-Resistenz (Resistenz gegen aktiviertes Protein C), die überwiegend auf eine Mutation im Faktor-V-Gen zurückgeht. Nach der Stadt der Erstbeschreibung wird sie als „Faktor-V-Leiden“ bezeichnet. Es handelt sich um eine „gain of function“-Mutation, die dazu führt, dass der aktivierte Faktor V (FVa) durch aktiviertes Protein C nicht rasch genug inaktiviert werden kann, sodass zu viel Thrombin gebildet wird („APC-Resistenz“). In sehr seltenen Fällen findet man andere FV-Mutationen mit ähnlicher Konsequenz. Eine APC-Resistenz kann auch erworben sein (zum Beispiel durch Schwangerschaft oder bei Entzündungen).
Ebenfalls bedeutsam, wenn auch seltener, ist eine Mutation im Bereich des Gens für den Faktor II (G20210A), die zu erhöhter Expression von Prothrombin führt. Seltenere genetische Ursachen für VTE sind qualitative oder quantitative Mängel an Protein C, Protein S und Antithrombin sowie erhöhte Spiegel von Faktor VIII und anderen Gerinnungsfaktoren. Weitere in der Tabelle aufgeführte Risikofaktoren sind bekannt, werden heute aber für pathogenetisch weniger wichtig gehalten.
Auch die paroxysmale nächtliche Hämoglobinurie (PNH) geht mit massiv gesteigertem Thromboembolierisiko einher (62-fach, zum Vergleich: Protein C-Mangel 8-fach). Ähnlich wie bei den Leukämien liegt hier eine erworbene (somatische) Genmutation vor. Sie betrifft das Gen für Phosphatidyl-Inositol-Glykan-A (PIG-A) in den multipotenten hämatopoetischen Stammzellen des Knochenmarks. Wegen ihrer hohen Mortalität muss bei ungeklärten Thrombosen eine PNH ausgeschlossen werden. Per Flowzytometrie lassen sich defekte Zellklone (insbesondere Erythrozyten und Granulozyten) identifizieren und quantifizieren. Eindeutig ist die Diagnostik, wenn auf mindestens zwei Zelllinien typische Schutzfaktoren (CD55, CD59) fehlen, die das Komplementsystem regulieren.
Autoimmunreaktionen
Unter den erworbenen Ursachen für eine Thrombophilie spielen akute und chronische Entzündungen – auch im Gefolge von Autoimmunerkrankungen – die größte Rolle. IgG-Antikörper gegen Plättchenfaktor-4/Heparin-Komplexe bei der Heparin-induzierten Thrombozytopenie (HIT) gehören zu den stärksten bekannten Risikofaktoren für thromboembolische Erkrankungen überhaupt. Daher sollte in jedem Krankenhaus ein HIT-Test rund um die Uhr vorgehalten werden.
Ebenfalls durch Autoantikörper ausgelöst wird die Thrombophilie beim Antiphospholipidsyndrom (APS). Hier findet man Antikörper gegen die Phospholipid-bindenden Abschnitte verschiedener Proteine wie etwa β-2-Glykoprotein I, Prothrombin oder Protein C. Manche dieser als „Lupus Antikoagulanzien“ (LA) bezeichneten Antikörper erkennt man an einer verlängerten aPTT, auch wenn sie selten gerinnungshemmend, sondern fast immer thrombogen wirken. aPTT-Reagenzien weisen große Unterschiede in Bezug auf die LA-Empfindlichkeit auf. Als Bestätigungstest eignet sich insbesondere die DRVVT (Dilute Russell‘s Viper Venom Time), eine Gerinnungszeit mit verdünntem Gift der Russelviper. Für ein eindeutiges Ergebnis muss ein LA von einem Faktorenmangel differenziert werden, und das zweimal im Abstand von mindestens drei Monaten ohne medikamentöse Gerinnungshemmung.
Eine aktuelle Bevölkerungsstudie aus Dänemark zeigte, dass auch ein Rheumafaktorwert (RhF) von mehr als 100 IU/ml ein stark erhöhtes Risiko für Beinvenenthrombosen, nicht aber Lungenembolie anzeigt. Man vermutet, dass RhF ein Indikator für eine gestörte Endothelfunktion ist.
Sonstige Entzündungen
In einer Studie mit über 10.000 Teilnehmern waren tiefe Beinvenenthrombosen und Lungenembolien in der Gruppe mit den höchsten CRP-Werten um 76% häufiger als beim Rest der Bevölkerung. Auch andere Entzündungsmarker wie TNF-α, IL-6 und IL-8 zeigen ein erhöhtes VTE-Risiko an. Pathogenetisch bedeutsam ist der inflammatorische Anstieg von Fibrinogen, FVIII und VWF, sowie das Absinken von freiem Protein S durch Komplexbildung mit dem C4-Binding Protein aus dem Komplementsystem. Nach 2015 publizierten Ergebnissen wirken Entzündungen durch Oxidation von VWF und oxidative Inaktivierung von ADAMTS13 durch Granulozyten thrombogen.
Lipoproteine
Genetisch erhöhte Spiegel von Lp(a) führen zu einem deutlich erhöhten Risiko für arterielle und venöse Gefäßverschlüsse. Bei männlichen Thrombosepatienten findet man auch häufig niedrige HDL-Spiegel; HDL verstärkt anscheinend die antikoagulatorische Wirkung von APC/Protein S und verändert die Fibrinstruktur. Außerdem stimuliert HDL die Produktion von Prostacyclin und Stickstoffmonoxid (NO) in Endothelzellen. Beide sind potente Inhibitoren der Thrombozytenaktivierung.
Thrombozyten
Die Analytik von Thrombozytenfunktionsstörungen ist schwierig und erfordert entsprechende Laborexpertise. Aggregometrie, Flowzytometrie sowie der Platelet Function Analyzer (PFA 100, Innovance 200) erlauben eine Funktionsuntersuchung, die im Einzelfall durch molekularbiologische Methoden ergänzt werden kann. Hier sind insbesondere die Rezeptoren an der Plättchenoberfläche von Interesse, die mit anderen Plättchen, Plasmaproteinen oder der Gefäßwand kommunizieren. Polymorphismen von Kollagen- oder Fibrinogenrezeptoren sind nicht selten und können zu einer Steigerung der Plättchenfunktion führen.
Beim familiär gehäuften Sticky-Platelet-Syndrom („klebrige Plättchen“) findet man eine ungewöhnlich starke Aggregation der Thrombozyten durch das Stresshormon Adrenalin (Epinephrin). In der Konsequenz finden sich häufig arterielle Gefäßverschlüsse, gerade auch bei Vorliegen anderer Risikofaktoren wie Diabetes, Hypertonie oder Störungen im Lipidstoffwechsel. Auch ein Zusammenhang mit Schwangerschaftskomplikationen ist wahrscheinlich. Bei einer Hyperfunktion der Thrombozyten wird oft eine Therapie mit Aggregationshemmern vorgenommen. Hier kann zusätzlich zur Azetylsalizylsäure die Gabe eines P2Y12-Antagonisten indiziert sein.
Diagnostik und Screening
Der Nutzen der Labordiagnostik bei Verdacht auf Thrombophilie ist allein schon aus wirtschaftlichen Gründen nicht unumstritten. Anstelle eines ungezielten Rundumschlags sollte ein selektives Thrombophilie-Screening bei positiver Eigen- oder Familienanamnese – insbesondere bei jungen Patienten – erfolgen, wobei man oft stufenweise vorgeht: Zuerst sind die häufigen Fälle von FV-Leiden und Prothrombinmutation durch APC-Resistenz und Gentests auszuschließen, danach die selteneren Ursachen. Eine Zielgruppe, die von einem Screening sicher profitiert, sind Patienten mit APS und erster VTE, da sie wegen ihres hohen Rezidivrisikos oft eine längere Antikoagulation benötigen.
Bei asymptomatischen Patienten mit positiver Familienanamnese (gehäufte VTE bei Verwandten ersten Grades) ist ein Thrombophiliescreening ebenfalls sinnvoll, wenn eine Behandlung mit erhöhtem VTE-Risiko ansteht oder eine Schwangerschaft vorliegt, ebenso bei Patienten mit akuter VTE ohne offensichtliche Ursache.
Bei vielen anderen Indikationen wie etwa der Verschreibung von Antikontrazeptiva oder Östrogenen im Rahmen einer Osteoporoseprophylaxe oder auch bei der Untersuchung symptomloser Verwandter von Thrombophiliepatienten ist die Datenlage dagegen nicht eindeutig, sodass auf ein Screening oft verzichtet werden kann.
Bei einem positiven Befund ist die Indikation für eine medikamentöse Prophylaxe mit Bedacht zu stellen. Vor Einleitung einer Antikoagulation sind die Chancen sorgfältig gegen die Risiken abzuwägen. So können bei einem Mangel von Protein C oder S die immer noch häufig verschriebenen Vitamin-K-Antagonisten schwere Cumarinnekrosen auslösen, und ein AT-Mangel kann die Effizienz einer Heparingabe vermindern.
Bei Patienten, bei denen bislang eine Antikoagulation mit Vitamin-K-Antagonisten wegen der vielfältigen Nebenwirkungen nicht möglich war, erscheint eine Thrombophilieabklärung sinnvoll, um die neue Option der direkten Antikoagulanzien richtig bewerten zu können.