Ine Schmale
Die adjuvante Androgen-Deprivationstherapie (ADT) sollte entsprechend dem individuellen Risiko eingesetzt werden. In zwei Studien, die beim Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO-GU) 2018 in San Francisco präsentiert wurden, wurden Risikofaktoren für einen frühen Progress unter ADT bzw. die Auswirkungen einer längeren ADT auf die Prognose untersucht. Der Nutzen einer intensivierten Therapie des hormonsensitiven, metastasierten Prostatakarzinoms konnte nach Abirateronacetat/Prednison nun auch für Enzalutamid und Apalutamid gezeigt werden. Gegen den Androgenrezeptor (AR) gerichtete Therapien sind auch beim BRCA2-mutierten Prostatakarzinom eine wirksame Therapieoption.
Die adjuvante ADT im Fokus diverser Studien
Je nach Höhe des Progressionsrisikos erhalten Patienten mit Prostatakarzinom nach Prostatektomie eine Strahlentherapie und gegebenenfalls eine endokrine Therapie. Die empfohlene Dauer der endokrinen Therapie variiert zwischen vier bis sechs und 24–30 Monaten. Die Phase-III-Studie TROG 03.04 bestätigte diese Vorgehensweise mit einer Nachbeobachtungszeit von zehn Jahren [1].
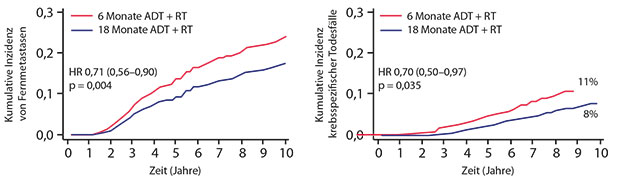
In der TROG-03.04-Studie (RADAR) erhielten 1.071 Patienten, die zwischen 2003 und 2007 in Australien und Neuseeland rekrutiert wurden, eine Androgensuppression plus Radiotherapie über die Dauer von 18 versus sechs Monaten. Primärer Endpunkt war die Prostatakarzinom-spezifische Mortalität (PCSM). Die Männer waren median 68,7 Jahre alt und zeigten in 66% der Fälle ein hohes sowie in 31% ein mittleres Risiko.
Es wurde eine signifikante Reduktion des Risikos beobachtet, am Prostatakarzinom zu versterben, wenn die Androgensuppression plus Radiotherapie über 18 anstatt 6 Monate gegeben wurde (HR 0,70; p = 0,035). Diese Reduktion der krebsspezifischen Mortalität war bedingt durch eine Verringerung des Risikos für eine Fernmetastasierung um 29% (HR 0,71; p = 0,004; Abb. 1).