Ine Schmale
Nachdem es zwischen 2007 und 2016 außer Sorafenib keine zugelassene systemische Therapieoption für Patienten mit fortgeschrittenem Leberzellkarzinom (HCC) gab, hat sich das Armamentarium in den Jahren 2017 und 2018 in den USA bisher auf fünf und in Europa auf zwei Substanzen für die Erst- und Zweitlinienbehandlung erweitert. Beim Gastrointestinal Cancers Symposium der American Society of Clinical Oncology (ASCO-GI) in San Francisco gab Ann-Lii Cheng, Taipei, Taiwan, einen Überblick über die in den USA derzeit verfügbaren Optionen [1], zu denen während des Kongresses auch weitere Daten vorgestellt wurden.
In Europa sind in der Behandlung des fortgeschrittenen HCC Sorafenib für die erste und Regorafenib für die zweite Therapielinie indiziert. Die Zulassung für Regorafenib basiert auf den Ergebnissen der Phase-III-Studie RESORCE, in der für die Therapie mit dem Tyrosinkinase-Inhibitor eine signifikante Überlebensverlängerung von median 7,8 auf 10,6 Monate gegenüber Plazebo gezeigt werden konnte [2]. Eingeschlossen waren Patienten mit dokumentiertem radiologischem Progress, die die Sorafenib-Therapie toleriert hatten und eine gute Leberfunktion (Child-Pugh A) aufwiesen – also ein selektiertes Patientenkollektiv mit besserer Prognose, wie Cheng bemerkte.
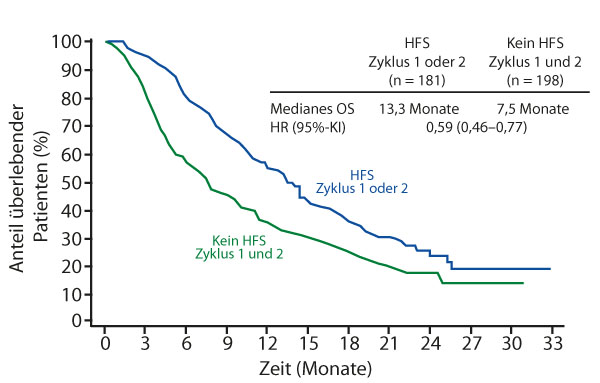
In einer in San Francisco präsentierten explorativen Post-hoc-Auswertung der Studie ergab sich ein Hinweis auf ein verlängertes Gesamtüberleben (OS) bei Auftreten eines Hand-Fuß-Syndroms (HFS) [3]. Trat ein HFS jedweden Grades im ersten Zyklus der Regorafenib-Therapie auf, so betrug das mediane Gesamtüberleben 13,2 versus 8,5 Monate für Patienten ohne HFS (HR 0,66). Bei einem HFS innerhalb der ersten zwei Zyklen überlebten die Patienten 13,3 versus 7,5 Monate lang (HR 0,59) (Abb. 1). Die Therapie mit Regorafenib solle daher bei Auftreten eines Hand-Fuß-Syndroms mit den empfohlenen Dosisreduktionen fortgeführt werden, schlussfolgerten die Autoren.