Tobias F. Jakobs, Stefanie Surwald, Christian Rust, Tim Sattler, Johannes Rieger, Johann Spatz
Das hepatozelluläre Karzinom (HCC) ist weltweit eine der führenden krebsbedingten Todesursachen. Die Mehrzahl der Tumoren entsteht auf dem Boden einer Leberzirrhose, was Diagnostik und Therapie verkompliziert. Bei der Therapieplanung muss neben Tumorausdehnung und -ausbreitung und dem Allgemeinzustand des Patienten insbesondere die Leberfunktion mitberücksichtigt werden. Zur Einschätzung der Prognose und Planung der geeigneten Therapie hat sich hier vor allem das BCLC-System der Barcelona Clinic for Liver Cancer bewährt. Nur etwa ein Drittel aller Patienten kann mittels Resektion, Transplantation oder lokaler Tumorablation kurativ behandelt werden. In den lokal fortgeschrittenen Fällen kommen vor allem transarterielle Verfahren wie die transarterielle Chemoembolisation (TACE) und die Radioembolisation (SIRT) zum Einsatz. Da das HCC relativ resistent gegen Chemotherapie ist, spielt diese eine untergeordnete Rolle in der Therapie. Mit der Einführung von Sorafenib für das fortgeschrittene und metastasierte HCC steht eine wirkungsvolle systemische Behandlung zur Verfügung. Besonderen Stellenwert hat die interdisziplinäre Betreuung, um alle für den einzelnen Patienten relevanten Therapieoptionen ausnutzen zu können.
Schlüsselwörter: Hepatozelluläres Karzinom, Lebertransplantation, Transarterielle Chemoembolisation, Radioembolisation, Thermoablation.
Das hepatozelluläre Karzinom (HCC) ist weltweit die dritthäufigste krebsbedingte Todesursache [1]. In den letzten Jahrzehnten hat seine Inzidenz stark zugenommen, für den Zeitraum 1975 bis 2005 wird für die USA sogar eine Verdreifachung der altersabhängigen Inzidenz beschrieben [2]. Zwar konnte zwischen 1992 und 2004 eine Verdoppelung der 2- und 4-Jahres-Überlebensraten dokumentiert werden, aber im Wesentlichen als Erfolg der Früherkennung, die zu früherer Diagnosestellung lokal und regional begrenzter Tumorstadien führt. Nichtsdestotrotz werden die meisten HCCs weiterhin in klinisch weiter fortgeschrittenen Stadien diagnostiziert. Da für diese Patienten bisher kaum wirksame Therapiemöglichkeiten existierten, sind die 1- und 5-Jahres-Überlebensraten mit 50% bzw. 10% weiterhin sehr niedrig [2]. Mit zunehmender Inzidenz und weiter niedrigen Überlebensraten bleibt das HCC in den nächsten Jahrzehnten eine große klinische Herausforderung, die gemeinsamer interdisziplinärer Anstrengungen bedarf.
90% aller HCCs entstehen auf dem Boden einer chronischen Lebererkrankung oder Zirrhose. Das höchste Risiko haben Patienten mit einer chronischen Virushepatitis. In den westlichen Ländern ist dies im Wesentlichen die Hepatitis C (HCV), in Südostasien die Hepatitis B. So liegt die jährliche HCC-Inzidenz bei Patienten mit HCV-assoziierter Leberzirrhose zwischen 2% und 8%, und HCV-positive Personen haben ein 20-fach erhöhtes HCC-Risiko [3]. Neben der alkoholtoxischen Leberzirrhose, der Hämochromatose und der primär biliären Zirrhose sind ein Diabetes mellitus und Adipositas bedeutsame Risikofaktoren für das HCC, die in engem Zusammenhang mit dem Lebensstil in der westlichen Welt stehen. Die dem HCC meist zugrunde liegende Leberzirrhose mit Leberinsuffizienz verkompliziert die Therapie der Erkrankung. So weisen Patienten mit kompensierter Child-Pugh-A-Zirrhose ohne HCC noch 1- und 2-Jahres-Überlebensraten von 95% und 90% auf, bei Child-Pugh-B-Zirrhose fallen diese dagegen schon auf 80% bzw. 70% ab [4]. Patienten mit dekompensierter Child-Pugh-C-Zirrhose haben aufgrund ihrer Leberinsuffizienz sogar ein Risiko von 50%, im Laufe eines Jahres zu versterben.
Multimodale Therapie des HCC
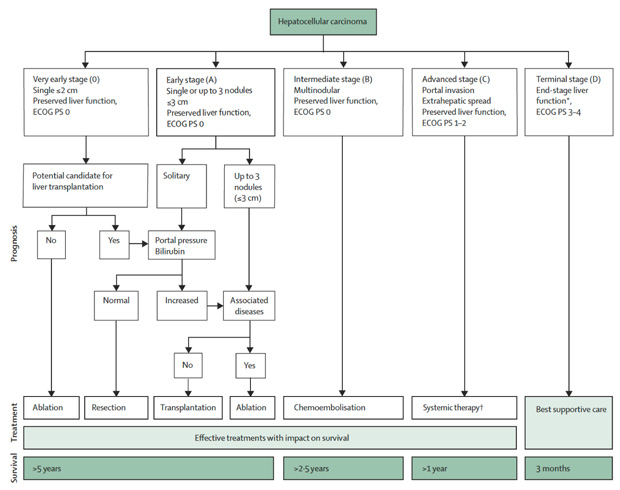
Die Prognose von Patienten mit soliden Tumoren wird entscheidend vom Tumorstadium bei Diagnose bestimmt. Die Prognose wird weiter beeinflusst durch den Allgemeinzustand, der eine Limitierung der Therapieintensität bedeuten kann. Bei Patienten mit HCC wird die Abschätzung der Prognose weiter kompliziert durch die dem HCC meist zugrunde liegende Leberinsuffizienz. Zahlreiche HCC-Staging-Systeme sind in der Vergangenheit vorgeschlagen und untersucht worden [5]. In den letzten Jahren hat sich das BCLC-Staging-System etabliert und wird von verschiedenen Fachgesellschaften empfohlen. Dieses von der Barcelona Clinic Liver Cancer Group entwickelte System berücksichtigt die Tumorgröße, die Leberfunktion, den Allgemeinzustand des Patienten und HCC-assoziierte Symptome. Basierend hierauf werden HCC-Patienten in fünf Gruppen eingeteilt. Das BCLC-System erlaubt so eine verlässliche Prognoseabschätzung und verweist gleichzeitig auf die für den Patienten geeignete Therapie (Abb. 1; [6]).