Molekulare Diagnostik pädiatrischer Tumoren
Diagnostik in der Onkologie
Die meisten Tumoren im Kindes- und Jugendalter sind heute durch Kombinationen aus Operation, Chemo- und Strahlentherapie prinzipiell heilbar. Etwa jeder vierte Patient erleidet aber immer noch ein Rezidiv – eine Situation, für die es häufig keine etablierten Therapieoptionen gibt. Hier setzt ein am Deutschen Krebsforschungszentrum (DKFZ) angesiedeltes, seit 2013 aktives bundesweites Programm an, mit dem molekulare Angriffspunkte für Medikamente in den Tumoren identifiziert werden sollen. Seit November 2016 wird dieses Programm am neugegründeten „Hopp-Kindertumorzentrum am NCT Heidelberg“ (KiTZ), einer Kooperation des Deutschen Krebsforschungszentrums und des Universitätsklinikums Heidelberg koordiniert. Tatsächlich bilden die molekulardiagnostischen Untersuchungen ein zentrales Element des präklinischen KiTZ Programms. Diese darin gewonnenen molekularen Informationen bilden wiederum die Grundlage für das translationale Programm des KiTZ, in dem eine Reihe klinischer Studien den betroffenen Patienten Zugang zu neuen, individualisierten Therapieoptionen ermöglichen sollen.
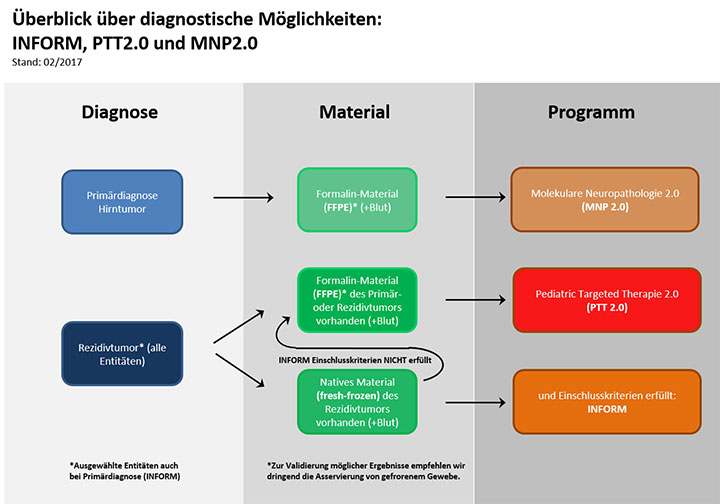
Abb. 1 zeigt eine Übersicht über die drei derzeit am KiTZ aktiven molekulardiagnostischen Studien und die für eine Teilnahme erforderlichen Voraussetzungen. Während sich die beiden Studien INFORM und PTT2.0 mit der Charakterisierung von Rezidiven aller kindlichen Tumorentitäten (darunter auch Hirntumoren) befassen, werden in die MNP-2.0-Studie Patienten mit der Primärdiagnose eines Hirntumors eingeschlossen.
Das INFORM-Register
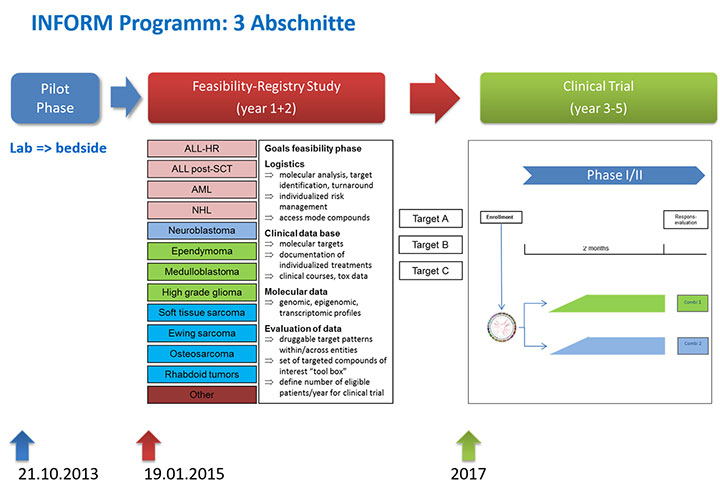
Die INFORM-Studie (Individualized Treatment For Relapsed Malignancies in Childhood) ist eine Registerstudie, in der pädiatrischen Patienten, die nach einer Krebserkrankung einen Rückfall erlitten haben, neue Behandlungsoptionen eröffnet werden sollen (Abb. 2).Die INFORM-Studie (Individualized Treatment For Relapsed Malignancies in Childhood) ist eine Registerstudie, in der pädiatrischen Patienten, die nach einer Krebserkrankung einen Rückfall erlitten haben, neue Behandlungsoptionen eröffnet werden sollen (Abb. 2). In der Studie, die seit Januar 2015 in Zusammenarbeit mit der Gesellschaft für Pädiatrische Onkologie und Hämatologie (GPOH) läuft und seit 2016 auf weitere Länder ausgeweitet wird, wird Gewebe aus dem Rezidivtumor (und gesundes Normalgewebe desselben Patienten) mithilfe hochmoderner Sequenzierungstechnologien umfassend molekulargenetisch charakterisiert und nach molekularen Angriffspunkten für zielgerichtete oder immuntherapeutische Behandlungsoptionen gescreent. Die Ergebnisse werden in einem Tumorboard mit molekularbiologischem Schwerpunkt besprochen, in einer Register-Datenbank gespeichert und darüber den behandelnden Ärzten zugänglich gemacht. Die Studie wird von der Deutschen Kinderkrebsstiftung, der Deutschen Krebshilfe, dem Deutschen Konsortium für Translationale Krebsforschung (DKTK) und dem Deutschen Krebsforschungszentrum (DKFZ) gefördert.

Das Prinzip
Das Prinzip des INFORM-Registers ist es, unabhängig von der Tumorart bei Patienten mit rezidivierter oder progredienter Krebserkrankung, für die es keine etablierten Behandlungskonzepte mehr gibt, den Rückfall-Tumor mit modernsten molekulargenetischen Methoden so genau wie möglich zu charakterisieren. Das Routineprogramm umfasst die Bestimmung von „Copy Number Variations“ mittels einer „Low-Coverage“-Gesamtgenom-Sequenzierung, eine Exom- und eine RNA-Sequenzierung, Genexpressions-Untersuchungen mittels Mircoarray und eine DNA-Methylierungsanalyse (Abb. 3). Anhand des dabei gewonnenen molekularen „Fingerabdrucks“ klassifiziert anschließend ein Expertengremium aus erfahrenen Kinderonkologen, Bioinformatikern, Biologen und Pharmakologen für jeden einzelnen Patienten die im Rezidivtumor gefundenen Veränderungen nach ihrer klinischen Relevanz. Diese werden dann in einem molekularen Tumorboard gemeinsam mit den Behandlern und den für die jeweilige Tumorart zuständigen Tumorgruppen der GPOH besprochen und priorisiert.
Zwar werden im Rahmen des Registers keine Therapieempfehlungen gegeben, aber die gewonnenen molekularbiologischen Informationen werden an die teilnehmenden Zentren und die behandelnden Ärzte weitergeleitet, die sie für die Behandlung nutzen können. Um aus den Untersuchungen weiterführende Erkenntnisse für die Kinderonkologie ableiten zu können, werden die Resultate der molekularen Analysen, v. a. die gefundenen klinisch relevanten Targets, aber auch die klinischen Verläufe und die eventuell dadurch angeregten Therapien (z. B. individuelle Heilversuche) prospektiv in einem Register erfasst und systematisch ausgewertet.
Zwischenfazit
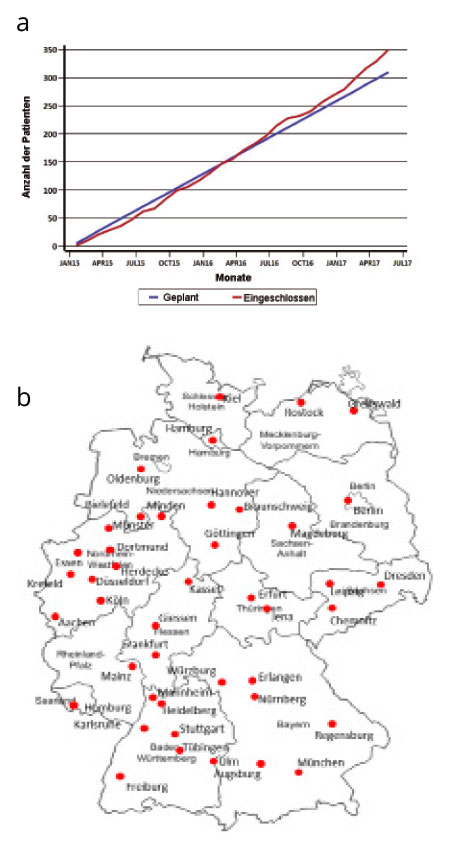
Nach Abschluss der Pilotphase mit 57 Patienten [1] hat die INFORM-Studie in mittlerweile zweieinhalb Jahren etwa 350 Patienten rekrutiert (Abb. 4a). Zurzeit nehmen 41 GPOH-Zentren in Deutschland teil (Abb. 4b), und seit Ende 2016 beteiligen sich zusätzlich Zentren in einigen kooperierenden europäischen Ländern wie Schweden, der Schweiz, Finnland sowie in Kürze auch Österreich und Australien. Darüber hinaus werden aktuell enge Kooperationen mit Arbeitsgruppen in den Niederlanden und in Großbritannien, die ähnliche Projekte planen, initiiert.
Logistik und Arbeitsabläufe sind inzwischen routinemäßig etabliert und werden ständig verbessert. Die Turnaround-Zeit vom Eingang der Probe bis zur Erstellung des Target-Reports liegt aktuell im Mittel bei 23 Tagen. In circa zwei Drittel der Tumorproben wurden medizinisch relevante therapeutische Angriffspunkte gefunden, die sich über alle Tumorarten verteilen. An den wöchentlichen „Target Decision Boards“ (Molekulares Tumorboard) nimmt neben den jeweiligen Vertretern der für die Erkrankung relevanten GPOH-Studien fast immer der behandelnde Kinderonkologe teil. Inzwischen führen die Analysen bei etwa jedem fünften eingeschlossenen Patienten zu einer Behandlung mit einem oder mehreren zielgerichteten Medikamenten im Rahmen von klinischen Studien oder Einzelheilversuchen.
Interessanterweise zeigte sich bei einem Teil der Patienten mit Hirntumoren eine Diskrepanz zwischen der ursprünglichen, auf der Histopathologie basierenden und der molekularen Diagnose: So stellte sich vor allem bei rund einem Drittel der Patienten mit einem Medulloblastom als Primärtumor in den molekularen Analysen heraus, dass das vermeintliche Rezidiv in Wahrheit ein hochgradig malignes Gliom im Sinne eines Therapie-assoziierten Zweitmalignoms war. Zudem brachten die Analysen neue wissenschaftliche Erkenntnisse mit therapeutischer Relevanz zutage, wie zum Beispiel die Identifizierung bisher nicht beschriebener Genfusionen unter Einschluss des MET-Onkogens bei etwa 10% der pädiatrischen Glioblastome [2].
Ausblick
Die Ergebnisse der INFORM-Registerstudie sollen als Grundlage für eine Serie klinischer Interventionsstudien dienen, in denen im Rahmen des translationalen KiTZ-Programmes im“ KiTZ Early Clinical Trial Center“ in einem kontrollierten Design Kombinationen von zielgerichteten Medikationen getestet werden. Für die erste Substudie liegen inzwischen Zusagen für die Bereitstellung der Prüfmedikation von Industrieseite vor, sodass das Protokoll nun finalisiert werden kann. Im Februar 2017 tagte eine INFORM2-Studienkommission, an der zahlreiche Experten der GPOH teilnahmen, um konkrete Aspekte dieser Studien zu thematisieren.
Das PTT2.0-Register
Die Teilnahme an der INFORM-Studie ist an strikte Einschlusskriterien gebunden, zum Beispiel muss frisch eingefrorenes Gewebe aus dem Tumorrückfall verfügbar sein (Abb. 1). Viele pädiatrische Patienten mit Rückfällen erfüllen diese Kriterien nicht: Häufig steht beispielsweise nur Paraffin-Material vom Rezidiv zur Analyse zur Verfügung oder es befindet sich nach Tumorresektion kein Resttumor im Patienten, an dem man ein Ansprechen auf eine Therapie nach INFORM-Empfehlung messen könnte. Um auch solchen Patienten (bis zu einem Alter von 22 Jahren) die Möglichkeit einer molekularen Diagnostik anzubieten, können sie in eine weitere Registerstudie, die PTT2.0-Studie (Pediatric Targeted Therapy 2.0), aufgenommen werden [3]. PTT2.0 wurde 2016 mit dem Ziel begonnen, auch in diesen Tumoren gezielt nach molekularen Zielstrukturen für medikamentöse Therapien zu fahnden.
In der PTT2.0-Studie wird ein gegenüber INFORM reduziertes Spektrum an molekularen Analysen angewendet. Durchgeführt werden eine DNA-Methylierungsanalyse zur Klassifizierung des Tumors, sowie zur Identifizierung therapeutisch oder diagnostisch nutzbarer chromosomaler Aberrationen, die Sequenzierung eines Panels von mehr als 140 tumorrelevanten Genen in Tumor und Blut des Patienten, sowie eine immunhistochemische Untersuchung der Aktivität von therapeutisch angreifbaren Signalkaskaden (mTOR-, MAPK- und PI3K-Signalweg).
Die Resultate der molekularen Analysen werden in einem interdisziplinären Tumorboard besprochen, in dem auch mögliche therapeutische Ansätze diskutiert werden. Der behandelnde Arzt erhält eine Übersicht der Analyseergebnisse und deren Interpretation mit Hinweisen auf mögliche Therapieoptionen. Um die Ergebnisse mit dem weiteren klinischen Verlauf des Patienten korrelieren zu können, werden die behandelnden Kliniken in regelmäßigen Abständen kontaktiert und um das Ausfüllen eines standardisierten Fragebogens gebeten.
Das Hopp-Kindertumorzentrum am NCT Heidelberg (KiTZ)
Das „Hopp-Kindertumorzentrum am NCT Heidelberg“ (KiTZ) ist eine gemeinsame Einrichtung des Universitätsklinikums Heidelberg und des Deutschen Krebsforschungszentrums (DKFZ). Das KiTZ ist gleichzeitig Therapie- und Forschungszentrum für onkologische und hämatologische Erkrankungen im Kindes- und Jugendalter. Es verfolgt das Ziel, die Biologie kindlicher Krebserkrankungen wissenschaftlich zu ergründen und vielversprechende Forschungsansätze möglichst frühzeitig in die Patientenversorgung einzubringen – von der Diagnose über die Behandlung bis hin zur Nachsorge. Krebskranke Kinder, gerade auch diejenigen, für die keine etablierten Behandlungsoptionen zur Verfügung stehen, erhalten im KiTZ einen individuellen Therapieplan, den Experten verschiedener Disziplinen in Tumorkonferenzen gemeinsam erstellen. Viele junge Patienten können an klinischen Studien teilnehmen und damit Zugang zu neuen Therapieoptionen erhalten. Beim Übertragen von Forschungserkenntnissen aus dem Labor in die Klinik übernimmt das KiTZ damit Vorbildfunktion.
Die drei Programme des KiTZ
Im KiTZ-Programm I „Klinische Pädiatrische Onkologie“ (Leitung: Prof. Dr. Andreas Kulozik) werden Kinder mit Krebs- und schweren Bluterkrankungen ambulant, tagesklinisch und stationär versorgt. Auch die Durchführung klinischer Studien zur Verbesserung der Heilungschancen ist Teil dieses Programmes.
Im KiTZ-Programm II „Translationale Pädiatrische Onkologie“ (Leitung: Prof. Dr. Olaf Witt) werden innovative individualisierte Behandlungsformen für Kinder mit malignen Erkrankungen zusammengefasst. Im Fokus steht die Translation neuer Forschungsergebnisse in frühe klinische Studien – v. a. für Patienten, bei denen die etablierten Therapieoptionen ausgeschöpft sind.
Im KiTZ-Programm III „Präklinische Pädiatrische Onkologie“ (Leitung: Prof. Dr. Stefan Pfister) arbeiten experimentelle kinderonkologische Forschergruppen des Universitätsklinikums und des DKFZ daran, neue diagnostische Verfahren für die Klassifizierung von Tumorerkrankungen zu entwickeln, neue Mechanismen der Tumorentstehung zu identifizieren und Therapieansätze daraus abzuleiten.
Das MNP-2.0-Register
Auch bei der Primärdiagnose eines Hirntumors im Kindes- und Jugendalter lässt sich die diagnostische Genauigkeit durch den zusätzlichen Einsatz molekulargenetischer Analysen verbessern. Einen Beitrag hierzu soll die Registerstudie MNP 2.0 (Molekulare Neuropathologie 2.0) leisten, die seit 2015 läuft. Dabei werden neu diagnostizierte Hirntumoren parallel zur etablierten referenzpathologischen Klassifikation auch molekulargenetisch charakterisiert und die Ergebnisse miteinander abgeglichen. MNP 2.0 dient zum einen dazu, den Nutzen der molekularen Analyse in Diagnostik und Klassifikation systematisch zu bewerten, und soll zum anderen die flächendeckende molekularbiologische Charakterisierung kindlicher Hirntumoren in Deutschland ermöglichen. Auch hier werden die Ergebnisse den behandelnden Ärzten zur Verfügung gestellt, wobei schwer zu klassifizierende Fälle in einem interdisziplinären Tumorboard diskutiert werden. In die MNP-2.0-Studie werden inzwischen etwa 80% aller in Deutschland diagnostizierten Kinder mit Hirntumoren aufgenommen. Darüber hinaus wird die MNP-2.0-Studie – wie auch INFORM – derzeit internationalisiert. Erste Länder, welche ebenfalls in MNP 2.0 rekrutieren werden, sind Australien und die Schweiz. Das MNP-2.0-Register wird von der Deutschen Kinderkrebsstiftung gefördert und läuft in Kooperation mit dem HIT-Netzwerk der Gesellschaft für Pädiatrische Hämatologie und Onkologie.
Jonas Ecker, Felix Sahm, Dominik Sturm, David Jones,
Kristian Pajtler, Till Milde, Olaf Witt, Stefan M. Pfister
Literatur
1. Worst BC et al. Next-generation personalised medicine for high-risk paediatric cancer patients - The INFORM pilot study. Eur J Cancer 2016; 65: 91-101.
2. Bender et al. Recurrent MET fusion genes represent a drug target in pediatric glioblastoma. Nature Med 2016; 22: 1314-20.
3. Selt F et al. Pediatric Targeted Therapy: Clinical Feasibility of Personalized Diagnostics in Children with Relapsed and Progressive Tumors Brain Pathol. 2016 Jul;26(4):506-16.
Prof. Dr. Olaf Witt
KiTZ – Hopp Kindertumorzentrum am NCT Heidelberg
+49 6221 56 4555
olaf.witt[at]med.uni-heidelberg[dot]de
Prof. Dr. Stefan Pfister
KiTZ – Hopp Kindertumorzentrum am NCT Heidelberg
+49 6221 42 4618
s.pfister[at]dkfz[dot]de
Weitere Informationen zu
den Studien über:
KiTZ Presse- und Öffentlichkeitsarbeit
Dr. Elke Matuschek
e.matuschek[at]dkfz[dot]de
+49 6221-56 36434

