Diagnostik und Therapie der akuten myeloischen Leukämie
Wichtige Fortschritte im pathophysiologischen Verständnis der AML wurden vor allem durch die Aufklärung der zugrunde liegenden genetischen Veränderungen in den letzten Jahren erzielt. Diese werden zurzeit vor allem zur risikoadaptierten Therapie sowie zur Bestimmung der minimalen Resterkrankung genutzt. Therapeutische Fortschritte umfassen z. B. die Optimierung der allogenen Stammzelltransplantation, supportive Maßnahmen sowie zielgerichtete Substanzen wie z. B. FLT3-/IDH-Inhibitoren, Antikörper-Konjugate oder ATO in der Primärtherapie der APL. Die größten Herausforderungen der AML-Therapie stellen Patienten mit Hochrisiko-AML (primär refraktäre Patienten, Patienten im Rezidiv und ältere Patienten) dar. Um in diesen Fällen eine Therapieverbesserung zu erreichen, ist eine Therapie in klinischen Studien, in Deutschland z. B. im Rahmen der AML Cooperative Group (AMLCG) oder der Study Alliance Leukemia (SAL), unbedingt erforderlich. Informationen zu diesen Studien sind unter www.kompetenznetz-leukaemie.de zu finden.
Schlüsselwörter: akute myeloische Leukämie, akute Promyelozyten-Leukämie, WHO-Klassifikation, ELN-Empfehlungen, zielgerichtete Therapien, FLT3-Inhibitoren, IDH-Inhibitoren, Antikörper-Toxin-Konjugate, Arsentrioxid
Akute myeloische Leukämien (AML) sind maligne hämatologische Neoplasien mit einem medianen Erkrankungsalter von 65–75 Jahren. Die jährliche Inzidenz liegt bei ca. 3/100.000 und steigt im Alter stark an. Obwohl das Alter einen kontinuierlichen Risikofaktor darstellt, wird in den meisten Arbeiten die Grenze von 65 Jahren für die Definition „ältere Patienten“ gewählt.
Klinische Symptome
Die klinischen Symptome sind im Wesentlichen Folgen der peripheren Zytopenien (Infektionen, Blutungen, Anämie-Symptome), Symptome extramedullärer Manifestationen (z. B. Meningeosis leucaemica) oder Leukämie-assoziierter Gerinnungsstörungen. Häufig führen die Blutbildveränderungen zur Verdachtsdiagnose AML. Es muss eine dringliche Abklärung, in der Regel in einem hämatologischen Zentrum erfolgen. Insbesondere die akute Promyelozyten-Leukämie (APL) ist ein hämatologischer Notfall, der auch bei einem bloßen Verdacht eine unmittelbare Therapieeinleitung notwendig macht.
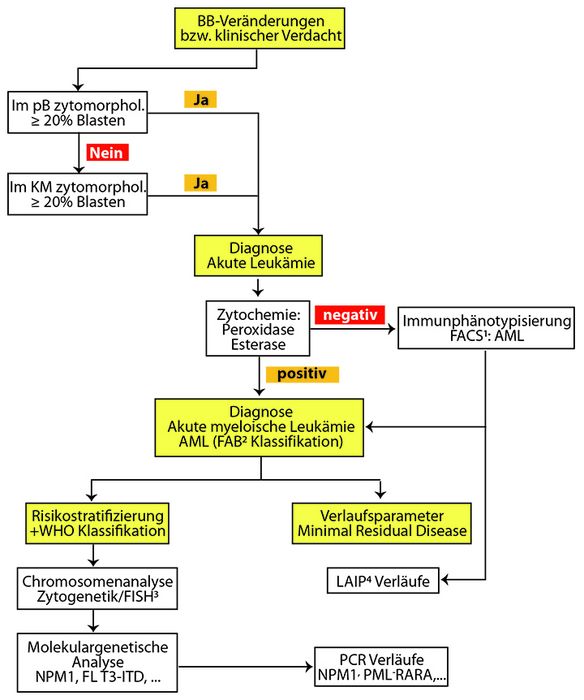
Ein diagnostischer Algorithmus ist in Abb. 1 dargestellt und beruht auf einer zytomorphologischen und zytochemischen (POX/EST) Untersuchung von Blut und Knochenmark. Bei einer Blasten-Vermehrung von > 20% in Blut oder Knochenmark liegt definitionsgemäß eine akute Leukämie vor, die entweder zytochemisch oder spätestens durchflusszytometrisch der lymphatischen oder myeloischen Reihe zugeordnet werden kann.
Diagnostik und Klassifikation
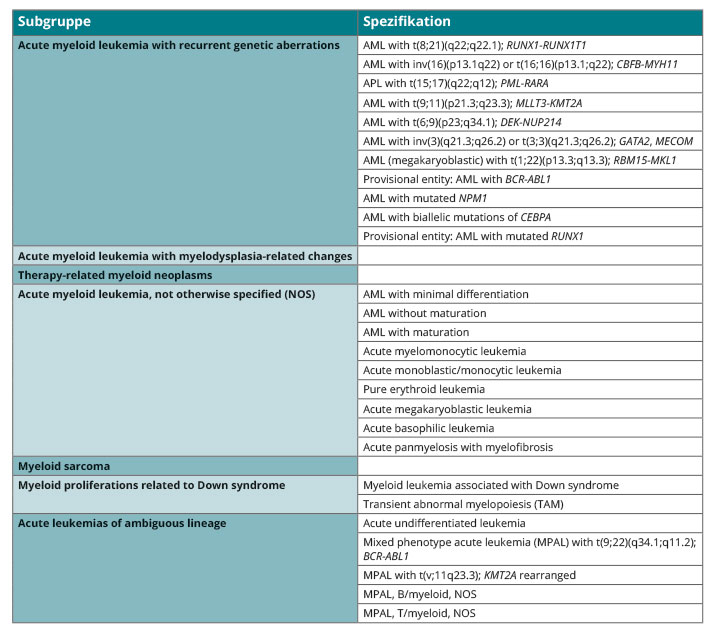
Die Diagnostik und Klassifikation der AML erfolgt gemäß der WHO-Klassifikation von 2016, die neben der morphologischen Definition klinische und genetische Kategorien in den Vordergrund stellt (Tab. 1; [1]). Eine detaillierte Darstellung der für die AML empfohlenen Diagnostik und Response-Kriterien sowie der Therapie findet sich in den ELN2017-Empfehlungen (Tab. 2; [2]).
Neben der klassischen Zytomorphologie, die neben der Durchflusszytometrie der Diagnose dient, erlauben die Zytogenetik und die Molekulargenetik die Bestimmung von diagnostischen und prognostischen Markern. In Einzelfällen kann die Analyse von molekulargenetischen Markern, z. B. durch Gen-Panel-Analysen, eine Abgrenzung von reaktiven Veränderungen eines MDS ermöglichen. Da eine klonale Hämatopoese (Clonal Hematopoiesis of Indeterminate Potential, CHIP) bei ca. 5% der über 70-Jährigen gefunden werden kann, müssen diese Analysen mit Vorsicht interpretiert werden [3].
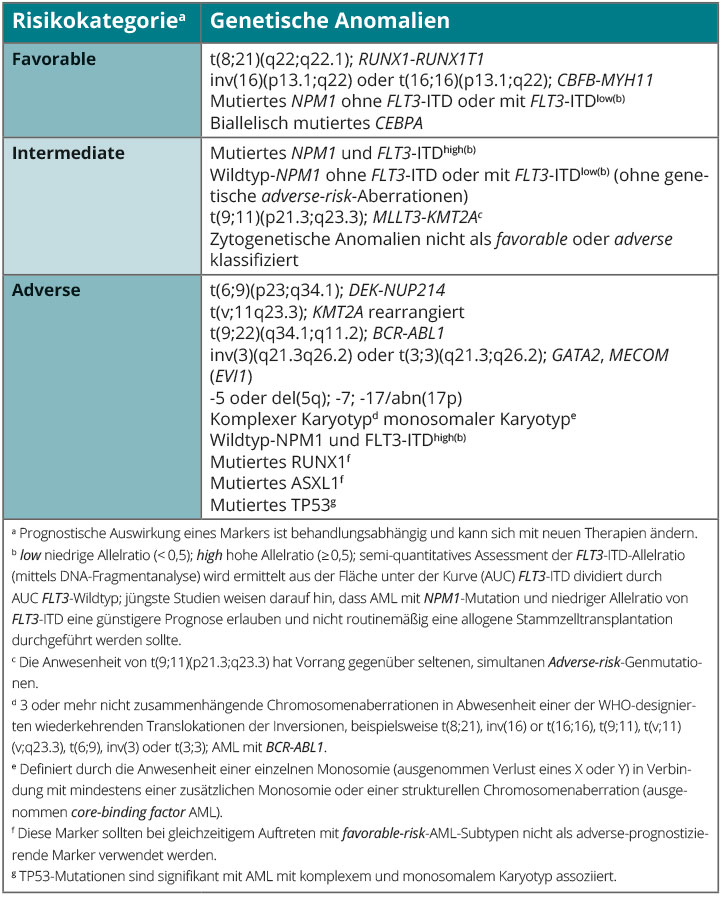
Genmutationen werden bei der AML in der neuen ELN-Klassifikation 2017 zur Risikostratifizierung berücksichtigt [2]. Hierzu gehören bei Patienten mit normalem Karyotyp (NK-AML) die Bestimmung des Gen-Mutationsstatus von
CEBPA, NPM1, FLT3, RUNX1, ASXL1, TP53 sowie die Allel-Ratio von FLT3-ITD. Die prognostische Klassifikation ist in der ELN-Klassifikation von 2017 [2] zusammengefasst und unterscheidet drei prognostische Subgruppen („favorable“, „intermediate“ und „adverse“). Diese reflektieren im Wesentlichen die Empfindlichkeit der Erkrankung auf eine konventionelle Chemotherapie und dienen der risikoadaptierten Postremissions-Therapie.
Bei älteren Patienten sollten neben der biologischen Krankheitsklassifikation auch die patientenspezifischen Risikofaktoren erfasst werden. Diese umfassen Lebensqualität (QoL), Performancestatus (PS), Komorbiditäten sowie ein geriatrisches Assessment (GA) [4]. Die Bedeutung des GA konnte in einer Metaanalyse von 18 Publikationen aus 15 Studien mit hämatologischen Neoplasien gezeigt werden [5]. Geriatrische Einschränkungen wurden in der IADL-Skala (Instrumental Activities of Daily Living) bei 55%, im Ernährungsstatus bei 67% und bezüglich kognitiver Defizite bei 83% der im Median 73 Jahre alten Patienten beschrieben. Komorbiditäten, körperliche Aktivität und Ernährungsstatus waren häufiger prädiktiv für Toxizität und Mortalität als kalendarisches Alter und PS.
Die Durchführbarkeit eines GA im stationären Setting wurde in einer kleinen Pilotstudie an 54 AML-Patienten
> 60 Jahre untersucht [6]. Die umfangreiche Analyse dauerte im Mittel 44 Minuten und zeigte, dass selbst bei Patienten mit einem guten PS (ECOG < 2) Einschränkungen in verschiedenen Dimensionen bei 24–50% der Patienten identifiziert werden können. Die gleiche Arbeitsgruppe konnte den prognostischen Wert des GA bezüglich der AML-Induktionstherapie zeigen und Grenzwerte für verschiedene Tools definieren [7]. Hierzu gehören die Short Physical Performance Battery (SBBP) sowie der 3MS-Test (100-point Modified Mental State Examination).
Eine Zusammenstellung und detaillierte Darstellung der verschiedenen GA-Tools findet sich z. B. auf der Homepage der International Society of Geriatric Oncology (SIOG) oder der DGHO [8] bzw. in den aktuellen SIOG-Empfehlungen [9].
Validierte Instrumente zur Erfassung von Komorbiditäten stellen der Charlson-Komorbiditäts-Index (CCI) und der Hematopoietic Cell Transplantation–Comorbidity Index (HCT-CI; www.hctci.org) dar.
Intensiv behandelbare jüngere Patienten
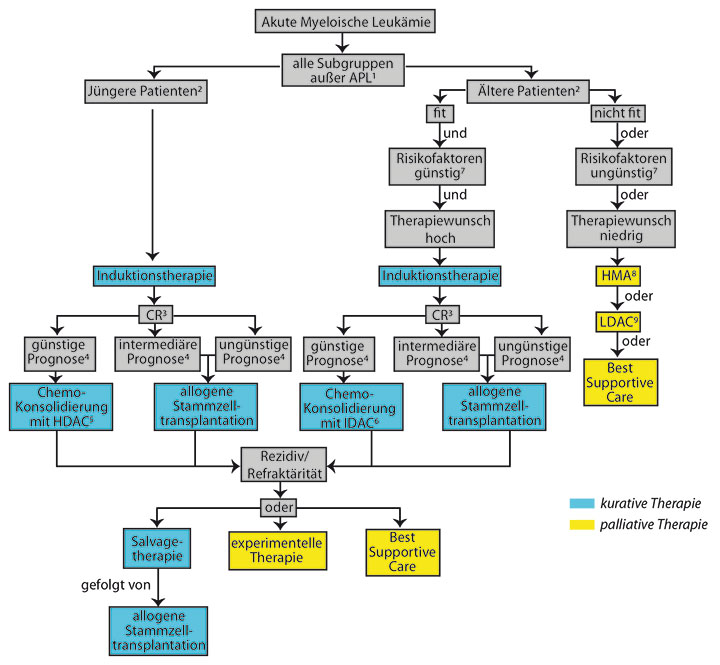
Die Diagnosestellung impliziert in der Regel die Indikation zur Therapieeinleitung (Übersicht Abb. 2). Ausnahmen stellen unbeherrschte Infektionen, ausgeprägte Komorbiditäten oder ein hohes Alter dar. Die Auswahl von Patienten, die für eine intensive Therapie geeignet sind, kann durch Scores wie z. B. den Score der AMLCG-Gruppe, die eine Abschätzung der Chancen für eine Komplettremission und des Risikos für Frühtodesfälle erlauben, unterstützt werden [10]. Eine Vorphase-Therapie mit Hydroxyurea oder Cytarabin kann bei großer Leukämie-Zellmasse, z. B. einer Hyperleukozytose, vor Beginn der eigentlichen Therapie zur Vermeidung eines Tumorlyse-Syndroms notwendig sein.
Induktionstherapie (jüngere Patienten)
Für eine intensive Therapie geeignete AML Patienten werden in Anlehnung an die ELN-Guidelines von 2017 [2] mit einer Standard-Induktionstherapie nach dem 7 + 3-Schema (drei Tage i. v. Anthracyclin, z. B. Daunorubicin 60 mg/m2, Idarubicin 12 mg/m2 oder Mitoxantron 12 mg/m2 und sieben Tage einer kontinuierlichen Infusion von Cytarabin (100–200 mg/m2) behandelt. Alternative Induktionsregimes wie z. B. dosisdichtes sequenzielles Hochdosis-AraC/Mitoxantron (S-HAM) können bei gleicher Therapieeffektivität die Dauer der kritischen Zytopenien verkürzen und werden z. B. von der AMLCG-Studiengruppe favorisiert.
Verschiedene Alternativen zum klassischen 7 + 3-Schema wurden in den letzten Jahren evaluiert, allerdings ohne klare Evidenz dafür, dass eine dritte Substanz oder eine AraC-Dosiseskalation einen Überlebensvorteil bringt. Im Gegensatz dazu ergaben vier Studien, dass eine Intensivierung der Anthrazyklin-Dosis in Subgruppen die Therapieeffektivität steigern kann:
Die ECOG-E1900-Studie verglich bei 657 jüngeren Patienten eine Daunorubicin-Dosis von 90 mg/m2 versus 45 mg/m2 in einem 3 + 7-Schema als ersten Induktionskurs [11]. Die höhere Dosis erzielte eine höhere Remissionsrate und ein längeres Gesamtüberleben (23,7 vs. 15,7 Monate). Ähnliche Ergebnisse wurden in der HOVON-SAKK-Studiengruppe bei älteren Patienten beobachtet. Hier war ebenfalls die Remissionsrate verbessert, aber das Gesamtüberleben war nur in der Subgruppe der 60–65-jährigen überlegen (38% vs. 23%; [12]. Diese Daten werden gestützt durch eine koreanische Studie bei jüngeren Patienten, die zeigen konnte, dass eine höhere Daunorubicin-Dosis (90 mg/m2 vs. 45 mg/m2, kontinuierliche Infusion über drei Tage) eine höhere Remissionsrate und ein längeres Gesamtüberleben induziert [13].
In einer japanischen Studie wurde bei 1.057 jüngeren AML-Patienten untersucht, ob eine hochdosierte Daunorubicin-Applikation von 50 mg/d für fünf Tage (Daunorubicin-Gesamtdosis 250 mg) einer Idarubicin-Gabe von 12 mg/m2 über drei Tage überlegen ist [14]. In dieser Studie ergaben sich keine Unterschiede bezüglich der Remissionsraten zwischen den Armen.
In der UK-NCRI-AML17-Studie wurden 1.206 jüngere Erwachsene mit AML oder Hochrisiko-MDS zwischen einem Induktionszyklus mit 90 mg/m2 oder 60 mg/m2 Daunorubicin an den Tagen 1, 3 und 5 plus Cytarabin randomisiert [15]. Als zweiter Induktionszyklus wurde Daunorubicin in der Dosis von 50 mg/m2 an den Tagen 1, 3 und 5 gegeben. Die Studie konnte keinen Unterschied in den Komplettremissionsraten zeigen (73% vs. 75%), jedoch war die 60-Tages-Mortalität in dem Arm mit 90 mg/m2 höher, allerdings ohne Einfluss auf das langfristige Gesamtüberleben.
Eine der wichtigen offenen Fragen bezüglich der Induktionstherapie betrifft den Stellenwert einer zweiten Induktionstherapie bei adäquater Blasten-Clearance, die im Rahmen von aktuellen Studien der SAL-Studiengruppen in Deutschland adressiert wird. Therapiekonzepte, die eine innovative Substanz in Kombination mit einer konventionellen Induktionstherapie untersuchen, finden sich im Abschnitt „Innovative Therapiekonzepte“.
Postremissionstherapie (jüngere Patienten)
Patienten mit einem günstigen genetischen Risikoprofil erhalten gemäß den ELN-Empfehlungen 2017 konsolidierend zwei bis vier Zyklen intermediär dosiertes Cytarabin (IDAC; beispielsweise 1.000–1.500 mg/m2 i. v. über drei Stunden alle zwölf Stunden an den Tagen 1–3). Bei Intermediär-/Hochrisiko-Patienten sollte bei niedrigem HCT-CI eine allogene Stammzelltransplantation erwogen werden.
Die Entscheidung zur allogenen Transplantation hängt von der Risiko-Nutzen-Abwägung zwischen Nicht-Rezidiv-Mortalität (NRM) bzw. -Morbidität versus Reduktion des Rezidivrisikos ab. Diese Entscheidung basiert auf dem prätherapeutischen biologischen Krankheitsprofil, z. B. nach ELN 2017 [2] sowie weiteren Empfänger-Faktoren (z. B. Komorbiditäten, Organfunktionen, geriatrisches Assessment), Spender-Faktoren (z. B. Verfügbarkeit, HLA-Identität) und Transplantationsfaktoren (z. B. Konditionierung). Die allogene Transplantation wird bei der AML üblicherweise bei einem Rezidivrisiko > 35–40% durchgeführt.
Es existieren keine randomisierten Studien, die eine allogene Transplantation gegen eine konventionelle Konsolidierung bei Patienten mit intermediärem Risikoprofil untersucht haben. Eine umfangreiche Metaanalyse aus dem Jahr 2009, die über 6.000 Patienten einschloss [16], zeigte einen Vorteil im Gesamtüberleben für die allogene Transplantation. Allerdings sind die Daten nicht konsistent. Eine kürzlich von der AMLCG publizierte prospektive Matched-Pair-Analyse konnte einen deutlichen Vorteil der allogenen Transplantation in Bezug auf das rezidivfreie, jedoch nicht das Gesamtüberleben in der Gruppe der Patienten mit intermediärem Karyotyp zeigen [17]. Diese Patienten sollten in prospektive Studien, z. B. die ETAL-1-Studie, die diese Fragestellung randomisiert untersucht, eingebracht werden.
Patienten mit Hochrisiko-AML nach ELN 2017, z. B. solche mit komplexem Karyoytp, haben eine deutlich niedrigere Komplettremissionsrate (40–50%) und ein hohes Rezidivrisiko von > 80% [18, 19]. Durch die mit dem komplexen Karyotyp assoziierten Deletionen/Mutationen im TP53-Gen weisen diese Patienten häufig eine primäre Zytostatika-Resistenz auf und profitieren nur bedingt von einer intensiven Chemotherapie. Innerhalb der Patienten mit Hochrisiko-AML wurde eine Subgruppe mit monosomalem Karyotyp identifiziert, die eine noch ungünstigere Prognose hat [20].
Aufgrund der extrem ungünstigen Prognose unter konventioneller Chemotherapie sollten diese Patienten (so früh wie möglich) allogen transplantiert werden, da dies für sie die einzig kurative Option ist. Die Überlegenheit der allogenen Transplantation ist in zahlreichen Arbeiten belegt, z. B. in einer Analyse der AMLCG [21] oder in der Metaanalyse von Koreth und Mitarbeitern [16]. Auch für Patienten mit einem monosomalen Karyotyp ist eine Prognoseverbesserung durch die allogene Transplantation nachgewiesen [22], obwohl dieser Genotyp auch nach Transplantation die Prognose bestimmt [23].
Intensiv behandelbare ältere Patienten
Ältere Patienten haben aufgrund von Krankheitsbiologie, Komorbiditäten und eingeschränkten funktionellen Reserven eine höhere Rate an Früh-Todesfällen (ED), weniger komplette Remissionen und ein deutlich kürzeres Gesamtüberleben als jüngere Patienten [24]. Zudem wird ein erheblicher Anteil dieser Patienten nicht intensiv behandelt. Eine kürzlich publizierte Kohortenstudie aus der SEER-Datenbank untersuchte 8.336 AML Patienten im Alter von über 65 Jahren aus den Jahren 2000–2009 [25]. Von ihnen wurden nur 40% intensiv behandelt, allerdings stieg diese Rate im Studienzeitraum von 35% (2000) auf 50% an (2009). Das mediane Überleben war am längsten für Patienten nach intensiver Therapie (18,9 Monate), verglichen mit 6,6 Monaten für Patienten, die hypomethylierende Substanzen erhielten sowie 1,5 Monaten für unbehandelte Patienten. Diese Daten belegen, dass auch bei ausgewählten älteren Patienten durch eine intensive Therapie eine signifikante Überlebensverlängerung erreicht werden kann.
Der AMLCG/SAL-Score (www.aml-score.org) kann verwendet werden, um Patienten zu identifizieren, die von einer intensiven Therapie profitieren (siehe oben). Ähnliche Scores wurden auch von der Southwest Oncology Group (SWOG) und am M. D. Anderson Cancer Center (MDACC) entwickelt [26].
Etablierte Risikofaktoren für ältere Patienten umfassen neben dem Alter den Performancestatus (ECOG > 1) und Komorbiditäten (z. B. CCI > 1). In Bezug auf das geriatrische Assessment wurden ein SBBP-Score < 9 und ein 3MS-Score < 77 vorgeschlagen [4]. Mit der Erfassung von Komorbidität und geriatrischem Assessment können drei Patientengruppen identifiziert werden: 1. „Fit“ (ECOG 0–1, keine Komorbiditäten oder Auffälligkeiten im geriatrischen Assessment), 2. „Vulnerable“ und 3. „Frail“ (ECOG ≥ 3, SBBP > 9, 3MS > 77, CCI > 1).
Diese Einteilung kann für einen therapeutischen Algorithmus genutzt werden, der, ergänzt um krankheitsbiologische Parameter wie die Zytogenetik, bei der Identifizierung von Patienten hilft, die von einer intensiven Therapie profitieren (Abb. 2; [27]). Allerdings steht eine prospektive Validierung in größeren Studien aus.
Induktionstherapie (ältere Patienten)
Die Induktionstherapie mit 7 + 3 (siehe oben) unterscheidet sich nicht von derjenigen bei jüngeren Patienten (ELN 2017; [2]). Üblicherweise wird bei adäquater Knochenmarksblasten-Clearance (< 10%) sieben Tage nach Ende des ersten Zyklus nur ein Induktionszyklus gegeben. Ältere Patienten und Patienten mit ungünstiger Genetik haben eine geringere Ansprechrate. Hier sind HMA oder eine klinische Studie zu diskutieren.
Konsolidierungstherapie (ältere Patienten)
Patienten mit günstiger Genetik nach ELN 2017 sollten mit zwei bis drei Zyklen IDAC (500–1.000 mg/m2 i. v. über drei Stunden alle zwölf Stunden von Tag 1–3 oder 500–1.000 mg/m2 i. v. über drei Stunden an den Tagen 1–5 oder 6) konsolidiert werden. Für Patienten mit intermediärem/ungünstigem Risikoprofil existieren keine Daten, die eine intensive Konsolidierungstherapie stützen. Bei niedrigem HCT-Komorbiditätsindex sollte eine allogene Stammzelltransplantation erwogen werden.
Nicht intensiv behandelbare Patienten
Ältere AML-Patienten, die nicht für eine intensive Therapie infrage kommen, werden bevorzugt mit hypomethylierenden Substanzen (HMA) wie Azacitidin oder Decitabin behandelt. In der AML-AZA-001-Studie zeigte sich eine Verbesserung des Gesamtüberlebens von
6,5 Monaten unter konventioneller Behandlung auf 10,4 Monate unter Azacitidin [28]. Im Vergleich zu konventioneller Behandlung konnte auch für Decitabin ein verlängertes Gesamtüberleben bei vergleichbarer Toxizität gezeigt werden [29]. Kürzlich publizierte Daten mit einem 10-tägigen Decitabin-Regime weisen darauf hin, dass insbesondere Patienten mit TP53-mutierter AML gut ansprechen [30]. Alternativen stellen Low-dose-AraC [31] bzw. supportive Therapiekonzepte ähnlich wie bei MDS dar.Innovative Therapiekonzepte
In den letzten Jahren wurden für die AML verschiedene innovative Therapien entwickelt, wovon einige bereits von der FDA zugelassen sind oder sich im Zulassungsverfahren befinden.
FLT3-Inhibitoren
Sorafenib, ein FLT3- und RAF-Inhibitor führte in der randomisierten
SORAML-Studie der SAL-Studiengruppe bei jüngeren AML-Patienten zu einer Verbesserung des ereignisfreien, jedoch nicht des Gesamtüberlebens [32]. In der randomisierten Phase-III-Studie RATIFY konnte durch die Hinzunahme des Multikinase-Inhibitors Midostaurin zu einer konventionellen Chemotherapie das Gesamtüberleben bei Patienten mit FLT3-Mutationen signifikant verbessert werden [33]. Diese Daten führten 2017 zur Zulassung von Midostaurin in Kombination mit einer konventionellen Chemotherapie durch die FDA [34].CPX-351
Eine liposomale Formulierung von Cytarabin und Daunorubicin in einem fixen molaren Verhältnis von 5 : 1 (CPX-351) wurde als Induktionstherapie für ältere Patienten mit intensiv behandelbarer Hochrisiko-AML (60–75 Jahre, ECOG 0–2) randomisiert gegen eine Standard-Induktionstherapie mit 7 + 3 geprüft. Die Phase-III-Studie konnte eine Verbesserung von Gesamt- und ereignisfreiem Überleben sowie der Rate an Komplettremissionen mit oder ohne vollständige hämatologische Erholung bei ähnlichem Nebenwirkungsspektrum zeigen [35]. Auch die 30- und 60-Tage-Mortalität waren für CPX-351 tendenziell geringer. Die Zulassung durch die FDA erfolgte 2017 für Patienten mit Hochrisiko-AML.
IDH-Inhibitoren
In der Phase-I/II-Studie AG221-C-001, in der 199 Patienten mit IDH2-Mutationen den IDH2-Inhibitor Enasidenib erhielten, konnte bei einer minimalen Behandlungsdauer von sechs Monaten eine Komplettremissionsrate von 19% erreicht werden. Weiterhin wurden von den 157 bezüglich Erythrozyten bzw. Thrombozyten transfusionspflichtigen Patienten 34% transfusionsunabhängig. Aufgrund dieser Daten wurde Enasidenib durch die FDA 2017 für Patienten mit rezidivierter/refraktärer AML und IDH2-Mutationen zugelassen.
CD33-Antikörper-Toxin: Gemtuzumab Ozogamicin
Eine Metaanalyse von fünf randomisierten Studien mit 3.325 Patienten konnte zeigen, dass die Hinzunahme von Gemtuzumab Ozogamicin (GO) zur konventionellen Chemotherapie nicht die Komplettremissionsrate erhöht, aber das Rezidivrisiko reduziert (OR 0,81; 95%-KI 0,73–0,90; p = 0,0001) und das Gesamtüberleben nach fünf Jahren verbessert (OR 0,90; 95%-KI 0,82–0,98; p = 0,01) [36]. In Subgruppenanalysen zeigte sich, dass insbesondere Patienten mit günstiger, aber auch jene mit intermediärer Zytogenetik profitieren. Eine Zulassung von GO durch die FDA wird erwartet.
Weitere Ansätze: Venetoclax
Unter zahlreichen vielversprechenden therapeutischen Konzepten sei hier nur eine Substanz erwähnt, die bereits zur Therapie der chronischen lymphatischen Leukämie zugelassen ist: Venetoclax, ein Bcl-2-Antagonist. In einer kleinen Phase-I/II-Studie zeigten sich in Kombination mit Low-dose-Cytarabin vielversprechende Ansprechraten von 65% bei älteren AML-Patienten [37].
8. MRD-gesteuerte Therapie
Eine weitere Individualisierung der Therapie ist durch die Bestimmung der minimalen Resterkrankung (MRD) mittels molekulargenetischer oder durchflusszytometrischer Methoden möglich. Mit hoher Sensitivität und Spezifität können Patienten mit NPM1-Mutationen und balancierten Translokationen, (z. B. AML1-ETO, CBFβ-MYH11) molekulargenetisch monitoriert werden [38, 39]. Erste Studien legen nahe, dass eine MRD-gesteuerte Therapie das Überleben von Patienten mit CBF-AML verbessern könnte [40]. Da es bisher keine ausreichenden Studiendaten gibt, die ein solches Vorgehen stützen, sollten diese Patienten ebenfalls in klinische Studien eingebracht werden.
Therapie der akuten Promyelozyten-Leukämie
Die Therapie der akuten Promyelozyten-Leukämie (APL) ist ein hämatologischer Notfall und erfordert den möglichst schnellen genetischen Nachweis des PML-RARA-Rearrangements mittels FISH oder PCR. Bei typischer Zytomorphologie und dringlicher klinischer Indikation (z. B. Gerinnungsstörung oder Hyperleukozytose) muss die Therapie auch ohne Vorliegen der genetischen Resultate begonnen werden. Die APL sollte nur in Zentren mit entsprechender Erfahrung behandelt werden.
Die deutschen AML-Studiengruppen haben eine Therapieempfehlung verfasst („German Intergroup recommendations on the diagnostic and therapeutic management of acute promyelocytic leukemia“), die im Kompetenznetz Leukämie verfügbar ist [41]. Hier sind auch Empfehlungen zur Supportivtherapie bei Gerinnungsstörungen sowie zur Diagnostik und Therapie des APL-Differenzierungssyndroms verfügbar.Risikostratifizierung
Die Kombination aus Leukozyten- und Thrombozytenzahl bei Erstdiagnose ist der wichtigste Risikofaktor für ein Rezidiv [42]. Für die Therapieentscheidung ist die Abgrenzung der Non-high-risk- (WBC ≤ 10.000/µl) von der High-risk-Gruppe (WBC > 10.000/µl) entscheidend.
Therapie der Non-high-risk-APL
Die APL0406-Studie zeigte eine Überlegenheit der Kombination aus All-trans-Retinsäure (ATRA) und Arsentrioxid (ATO) im Vergleich zum AIDA-Regime (ATRA/Idarubicin) in Bezug auf das Überleben bei geringerer Hämatotoxizität [43]. Die Daten wurden in der AML17-Studie des britischen Medical Research Council (MRC) bestätigt [44]. Aufgrund dieser Daten stellt die Therapie mit ATRA/ATO bei Erstdiagnose einen neuen Standard dar und ist seit 2016 auch durch die EMA zugelassen. Zu beachten ist, dass während der Induktionstherapie zur Vermeidung eines APL-Differenzierungssyndroms eine Steroidtherapie, gegebenenfalls mit zusätzlicher Gabe von Hydroxyurea erfolgen sollte.
Therapie der High-risk-APL
Die Therapie nach dem AIDA-Protokoll beinhaltet ATRA (ab Tag 1) sowie Idarubicin (12 mg/m2 an Tag 1, 3, 5 und 7). Dieser folgt eine Konsolidierungs- und Erhaltungstherapie. Im Rahmen der europäischen APOLLO-Studie wird zur Zeit der Stellenwert einer ATRA/ATO-Therapie bei diesen Patienten evaluiert.
Sonderfälle: Hyperleukozytose, Meningeosis,
Gerinnungsstörungen
Neben den typischen Manifestationen (siehe oben) können sich bei der Erstmanifestation oder im Rezidiv auch spezifische Leukämie-assoziierte Symptome manifestieren. Hierzu gehören z. B. Hyperleukozytosen, Verbrauchs-Koagulopathien oder auch neurologische Manifestationen, z. B. im Rahmen einer Meningeosis leucaemica. Zusätzlich können sich bei septischen Komplikationen auch Zeichen eines septischen Schocks überlagern. Schnelle Diagnostik und Therapie in einem erfahrenen hämatologischen Zentrum sind hier notwendig.
Therapie des Rezidivs
Intensiv behandelbare Patienten sollten im Rezidiv – mit Ausnahme von Patienten mit APL sowie von solchen mit günstigem Risikoprofil – umgehend einer allogenen Stammzelltransplantation zugeführt werden, da diese die besten kurativen Chancen bietet. Hierbei sollten etablierte Risikofaktoren wie der validierte EPI-Score berücksichtigt werden, der vier klinisch relevante Parameter (rezidivfreies Intervall nach der ersten Komplettremission, Zytogenetik bei Diagnose, Alter und frühere Stammzelltransplantation) einschließt [45].
In Abhängigkeit von der Proliferationskinetik und dem Risikoprofil kann eine Bridging-Therapie bis zur Transplantation notwendig sein. Diese kann entweder eine intensive Therapie (z. B. FLAG-IDA) mit dem Ziel der Induktion einer Komplettremission oder eine niedrig dosierte Therapie (z. B. Low-dose-AraC) sein. Diese Patienten sollten in klinischen Studien, z. B. der deutschen ETAL-3-Studie behandelt werden, die den Stellenwert einer Re-Induktionstherapie prüft.
Falls Patienten im Rezidiv nicht für eine allogene Stammzelltransplantation oder eine intensive Re-Induktionstherapie geeignet sind, ist mit Ausnahme der APL von einer palliativen Situation auszugehen. Bis auf bestimmte genetische Subgruppen wie z. B. Patienten mit IDH-Mutationen existieren keine spezifischen Therapieansätze. Die Möglichkeit zum Einschluss in eine klinische Studie sollte immer überprüft werden.
Literatur
1. Arber DA et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127: 2391-405.
2. Döhner H et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 2017; 129: 424-47.
3. Steensma DP et al. Clonal hematopoiesis of indeterminate potential and its distinction from myelodysplastic syndromes. Blood 2015; 126: 9-16.
4. Rao AV. Fitness in the elderly: How to make decisions regarding acute myeloid leukemia induction. Hematology Am Soc Hemtaol Edu Program 2016; 2016: 339-47.
5. Hamaker ME et al. The relevance of a geriatric assessment for elderly patients with a haematological malignancy – a systematic review. Leukemia Res 2014; 38: 275-83.
6. Klepin HD et al. The feasibility of inpatient geriatric assessment for older adults receiving induction chemotherapy for acute myelogenous leukemia. J Am Geriatrics Soc 2011; 59: 1837-46.
7. Klepin HD et al. Geriatric assessment predicts survival for older adults receiving induction chemotherapy for acute myelogenous leukemia. Blood 2013; 121: 4287-94.
8. Geriatrische Onkologie — Wissensdatenbank. (n.d.). Retrieved January 1, 2017, from www.onkopedia.com/de/wissensdatenbank/wissensdatenbank/geriatrische-onkologie.
9. Decoster L et al. Screening tools for multidimensional health problems warranting a geriatric assessment in older cancer patients: An update on SIOG recommendations. Ann Oncol 2015; 26: 288-300.
10. Krug U et al. Complete remission and early death after intensive chemotherapy in patients aged 60 years or older with acute myeloid leukaemia: A web-based application for prediction of outcomes. Lancet 2010; 376: 2000-8.
11. Fernandez HF et al. Anthracycline dose intensification in acute myeloid leukemia. N Engl J Med 2009; 361: 1249-59.
12. Löwenberg B et al. High-dose daunorubicin in older patients with acute myeloid leukemia. N Engl J Med 2009; 361: 1235-48.
13. Lee JH et al. A randomized trial comparing standard versus high-dose daunorubicin induction in patients with acute myeloid leukemia. Blood 2011; 118: 3832-41.
14. Ohtake S et al. Randomized study of induction therapy comparing standard-dose idarubicin with high-dose daunorubicin in adult patients with previously untreated acute myeloid leukemia: The JALSG AML201 Study. Blood 2011; 117: 2358-65.
15. Burnett AK et al. A randomised comparison of daunorubicin 90mg/m2 vs 60mg/m2 in AML induction: Results from the UK NCRI AML17 trial in 1206 patients. Blood 2015; 125: 3878-85.
16. Koreth J et al. Allogeneic stem cell transplantation for acute myeloid leukemia in first complete remission: A systematic review and meta-analysis of prospective clinical trials. J Am Med Ass 2009; 301: 2349-61.
17. Stelljes M et al. Allogeneic transplantation versus chemotherapy as postremission therapy for acute myeloid leukemia: A prospective matched pairs analysis. J Clin Oncol 2014; 32: 288-96.
18. Mrózek K et al. Prognostic significance of the European LeukemiaNet standardized system for reporting cytogenetic and molecular alterations in adults with acute myeloid leukemia. J Clin Oncol 2012; 30: 4515-23.
19. Röllig C et al. Long-term prognosis of acute myeloid leukemia according to the new genetic risk classification of the European LeukemiaNet recommendations: Evaluation of the proposed reporting system. J Clin Oncol 2011; 29: 2758-65.
20. Breems DA, Löwenberg B. Acute myeloid leukemia with monosomal karyotype at the far end of the unfavorable prognostic spectrum. Haematologica 2011; 96: 491-3.
21. Stelljes M et al. Allogeneic transplantation as post-remission therapy for cytogenetically high-risk acute myeloid leukemia: Landmark analysis from a single prospective multicenter trial. Haematologica 2011; 96: 972-9.
22. Cornelissen JJ et al. Comparative analysis of the value of allogeneic hematopoietic stem-cell transplantation in acute myeloid leukemia with monosomal karyotype versus other cytogenetic risk categories. J Clin Oncol 2012; 30: 2140-6.
23. Brands-Nijenhuis AVM et al. Monosomal karyotype as an adverse prognostic factor in patients with acute myeloid leukemia treated with allogeneic hematopoietic stem-cell transplantation in first complete remission: A retrospective survey on behalf of the ALWP of the EBMT. Haematologica 2016; 101: 248-55.
24. Ossenkoppele G, Löwenberg B. How I treat the older patient with acute myeloid leukemia. Blood 2015; 125: 767-74.
25. Medeiros BC et al. Big data analysis of treatment patterns and outcomes among elderly acute myeloid leukemia patients in the United States. Ann Hematol 2015; 94: 1127-38.
26. Walter RB et al. Prediction of early death after induction therapy for newly diagnosed acute myeloid leukemia with pretreatment risk scores: A novel paradigm for treatment assignment. J Clin Oncol 2011; 29: 4417-23.
27. Röllig C et al. Akute Myeloische Leukämie (AML). www.onkopedia.com/de/onkopedia/guidelines/akute-myeloische-leukaemie-aml/@@view/html/index.html.
28. Dombret H et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with > 30% blasts. Blood 2015; 126: 291-9.
29. Kantarjian HM et al. Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia. J Clin Oncol 2012; 30: 2670-7.
30. Welch JS et al. TP53 and decitabine in acute myeloid leukemia and myelodysplastic syndromes. N Engl J Med 2016; 375: 2023-36.
31. Burnett AK et al. A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic acid for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment. Cancer 2007; 109: 1114-24.
32. Röllig C et al. Addition of sorafenib versus placebo to standard therapy in patients aged 60 years or younger with newly diagnosed acute myeloid leukaemia (SORAML): A multicentre, phase 2, randomised controlled trial. Lancet Oncol 2015; 16: 1691-9.
33. Stone RM et al. Midostaurin plus chemotherapy for acute myeloid leukemia with a FLT3 mutation. N Engl J Med 2017; 377: 454-64.
34. Levis M. Midostaurin approved for FLT3-mutated AML. Blood 2017; 129: 3403-6.
35. Lancet JE et al. Final results of a phase III randomized trial of CPX-351 versus 7+3 in older patients with newly diagnosed high risk (secondary) AML. J Clin Oncol 2016; 34(15S): ASCO 2016, Abstract #7035.
36. Hills RK et al. Addition of gemtuzumab ozogamicin to induction chemotherapy in adult patients with acute myeloid leukaemia: A meta-analysis of individual patient data from randomised controlled trials. Lancet Oncol 2014; 15: 986-96.
37. Wie AH et al. Updated safety and efficacy results of phase 1/2 study of venetoclax plus low-dose cytarabine in tretament-naive acute myeloid leukemia patients aged ≥ 65 years and unfit for standard induction therapy. EHA 2017, Abstract #S473.
38. Shayegi N et al. The level of residual disease based on mutant NPM1 is an independent prognostic factor for relapse and survival in AML. Blood 2013; 122: 83-92.
39. Krönke J et al. Monitoring of minimal residual disease in NPM1-mutated acute myeloid leukemia: A study from the German-Austrian acute myeloid leukemia study group. J Clin Oncol 2011; 29: 2709-16.
40. Zhu HH et al. MRD-directed risk stratification treatment may improve outcomes of t(8;21) AML in the first complete remission: Results from the AML05 multicenter trial. Blood 2013; 121: 4056-62.
41. www.kompetenznetz-leukaemie.de/sites/kompetenznetz-leukaemie/content/e53457/e55758/e57007/NapoleonRegister_TreatmentRecommendation_Final_V3.0_20150630.pdf
42. Sanz MA et al. Definition of relapse risk and role of nonanthracycline drugs for consolidation in patients with acute promyelocytic leukemia: A joint study of the PETHEMA and GIMEMA cooperative groups. Blood 2000; 96: 1247-53.
43. Lo-Coco F et al. Retinoic acid and arsenic trioxide for acute promyelocytic leukemia. N Engl J Med 2013; 369: 111-21.
44. Burnett AK et al. Arsenic trioxide and all-trans retinoic acid treatment for acute promyelocytic leukaemia in all risk groups (AML17): Results of a randomised, controlled, phase 3 trial. Lancet Oncol 2015; 16: 1295-305.
45. Breems DA et al. Prognostic index for adult patients with acute myeloid leukemia in first relapse. J Clin Oncol 2005; 23: 1969-78.

Prof. Dr. med. Karsten Spiekermann
Medizinische Klinik III
Klinikum der Universität München
Campus Großhadern
Marchioninistr. 15, 81377 München
+49 89 4400 77567
+49 89 4400 19 77567
E-Mail schreiben