Epidemiologie
Als Erkrankungen des fortgeschrittenen Lebensalters dürften die myelodysplastischen Syndrome eine wachsende Bedeutung im internistischen Alltag im Allgemeinen und in der Hämatologie im Speziellen bekommen. Die Inzidenz über alle Altersgruppen liegt bei ca. 4/100.000 Einwohnern pro Jahr, steigt mit dem Alter kontinuierlich an und erreicht in der Altersgruppe der über 70-Jährigen 30/100.000 und Jahr. Dabei liegt das mediane Erkrankungsalter bei ca. 72 Jahren. Über alle MDS-Subtypen sind Männer etwas häufiger betroffen, das MDS mit isolierter Deletion (5q) weist eine Prädominanz für das weibliche Geschlecht auf [1].
Pathogenese
Verschiedene Prozesse, die mit der Pathogenese der MDS in Verbindung gebracht werden, reichen von der Erkrankung der hämatopoetischen Stammzell-Nische über immunologische Dysfunktionen bis hin zu Dysregulationen der proliferativen und apoptotischen Kapazität der hämatopoetischen Vorläuferzellen [2–4]. Die Anwendung molekularer Hochdurchsatzverfahren zur Aufklärung der pathobiologischen Grundlagen der MDS hat das pathogenetische Modell der Erkrankung deutlich verändert. Während die MDS über viele Jahre als monoklonale Erkrankungen angesehen wurden, muss man inzwischen davon ausgehen, dass es sich bei ihnen um oligoklonale Entitäten handelt, die durch das Nebeneinander verschiedener molekular veränderter Klone charakterisiert sind [5]. Dabei handelt es sich nicht um einen statischen Zustand, sondern um einen dynamischen Prozess, bei dem es im natürlichen Verlauf der Erkrankungen und insbesondere unter krankheitsmodulierenden Therapien zu einer bisher noch unvorhersehbaren Veränderung der klonalen Zusammensetzung in der Hämatopoese von MDS-Patienten kommt [6].
Klinik
Die klinische Präsentation eines MDS wird im Wesentlichen davon bestimmt, welche Zellreihe in welchem Ausmaß von der hämatopoetischen Insuffizienz betroffen ist. Da bei der Mehrheit der MDS-Patienten die Anämie die führende Zytopenie ist, sind es in der Regel mehr oder weniger stark ausgeprägte Anämie-Symptome, die die Patienten auffällig werden lassen. Zudem können bei schwerer Thrombozytopenie Blutungszeichen/-neigung und bei schwerer Neutropenie eine erhöhte Neigung zu Infekten bestehen. Darüber hinaus wurde zuletzt vermehrt über die Assoziation von MDS und Autoimmunerkrankungen berichtet, wobei Vaskulitiden zu den häufigsten mit MDS assoziierten Autoimmun-Phänomenen zählen. Ob es sich hierbei um eigenständige und koexistierende Krankheitsbilder handelt oder um Begleitphänomene im Sinne von paraneoplastischen Erkrankungen, ist noch weitgehend unklar. Umgekehrt wurde die chronische Immunstimulation bei Autoimmunerkrankungen mit einem erhöhten Risiko für myeloische Neoplasien in Verbindung gebracht.
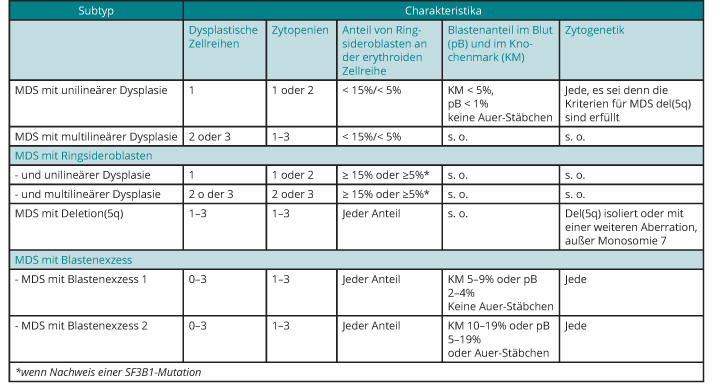
Klassifikation
Irritierenderweise konnte bisher bei Patienten mit zum Beispiel einer Neutro- und Thrombozytopenie, aber ohne eine Anämie, die Diagnose einer „refraktären Anämie“ gestellt werden, was historische Gründe hat. Diese irreführende Nomenklatur wurde in der revidierten und aktuellen WHO-Klassifikation zugunsten der Bezeichnung "Myelodyplastisches Syndrom" verlassen, was es sicher auch für Patienten einfacher macht, ihre Erkrankung nachzuvollziehen [7]. Darüber hinaus wurde erstmals eine Gen-Mutation in die Klassifikation aufgenommen: Liegt eine Mutation im SF3B1-Gen vor, reicht der zytochemische Nachweis von ≥ 5% Ringsideroblasten (s. Tab. 1), um die Diagnose eines MDS mit Ringsideroblasten zu stellen. Lässt sich eine solche Mutation nicht nachweisen, wird nach wie vor ein mindestens 15%iger Anteil von Ringsideroblasten an den erythroiden Vorläuferzellen gefordert. Formal zu beachten, jedoch im klinischen Alltag irrelevant ist, dass Patienten mit unilineärer Dysplasie, die drei Zytopenien aufweisen, als unklassifizierbare MDS (MDS-U) eingestuft werden, während dieselben Patienten mit einer Zytopenie oder zwei Zytopenien als MDS mit unilineärer Dysplasie bezeichnet werden. Der Vollständigkeit halber sei darüber hinaus erwähnt, dass Patienten mit einem wiederholt nachgewiesenen Blastenanteil im peripheren Blut von exakt 1% bei einem medullären Blastenanteil von < 5% ebenfalls als MDS-U klassifiziert werden.
Diagnostik
Zytomorphologie
Die Durchführung einer Knochenmark-Diagnostik mit Veranlassung zytomorphologischer, zytochemischer und zytogenetischer Untersuchungen ist obligat, um ein MDS diagnostizieren und korrekt einordnen zu können (s. Abschnitte Klassifikation und Risikostratifizierung). Die Knochenmark-Zytologie ist nach wie vor der Goldstandard in der Diagnostik der MDS, wobei nach Dysplasie-Zeichen und deren Ausmaß in der megakaryopoetischen, der granulopoetischen und der erythropoetischen Zellreihe gefahndet wird. Dabei gilt eine Zellreihe als dysplastisch, wenn mindestens 10% der Zellen dieser Zellreihe Dysplasiezeichen aufweisen. Neben dysplastischen Veränderungen, die in der Pappenheim-Färbung nachweisbar sein können, gelten auch Veränderungen als dysplastisch, die nur mittels zytochemischer Färbungen nachgewiesen werden können, wie die sogenannten Ringsideroblasten und der Peroxidase-Defekt.
Zytogenetik
Eine zytogenetische Untersuchung zur Karyotypisierung – die in ca. 50% der Fälle einen pathologischen Befund zeigt – ist obligat, da ohne diese 1.) eine korrekte Einordnung eines MDS nach WHO nicht gelingen, das heißt ein MDS mit isolierter Deletion (5q) nicht diagnostiziert werden kann und 2.) eine differenzierte Abschätzung des Krankheitsrisikos nicht möglich ist (s. Abschnitt Risikostratifizierung). Dabei sollte sich eine zytogenetische Untersuchung nicht nur auf die initiale Diagnostik beschränken, sondern sollte Bestandteil jeder Verlaufskontrolle (einmal jährlich bzw. bei Verdacht auf Progress oder Transformation) sein, um klonale Karyotyp-Evolutionen frühzeitig erfassen und therapeutische Maßnahmen anpassen zu können.
Molekulargenetik
Die Anwendung der modernen Hochdurchsatzverfahren zur Untersuchung des pathobiologischen Hintergrundes hat die molekulare Heterogenität der MDS offengelegt.
Zwar ist keine der bisher nachgewiesenen Mutationen spezifisch für ein MDS, sodass die genaue Diagnose „MDS“ insbesondere in zytomorphologisch unklaren Fällen nicht gesichert werden kann. Dennoch kann der Nachweis einer klonalen Hämatopoese geführt werden. Da aber auch hämatologisch gesunde Menschen Mutationen aufweisen können, die für myeloische Neoplasien typisch sind – wie DNMT3A, TET2 oder ASXL1 –, aber nie eine solche Erkrankung entwickeln, ist der Nachweis einer solchen Mutation alleine nicht beweisend für eine Kausalität der klonalen Hämatopoese bezüglich der klinischen Präsentation. Immer sollte eine sorgfältige Ausschlussdiagnostik hinsichtlich anderer Ursachen erfolgt sein, und Aberrationen in oben genannten Genen müssen in einem solchen Kontext interpretiert werden.
Auch gibt es bei den MDS bisher kein Gen, dessen Mutation eine direkte therapeutische Konsequenz hätte. Dies liegt zum einen daran, dass die pathophysiologische und prognostische Relevanz vieler Mutationen und deren Kombinationen noch unklar ist. Zum anderen sind bisher nur wenige Substanzen verfügbar, die auf Produkte (also Proteine) dieser Aberrationen zielen. Allerdings werden in zunehmendem Maße Substanzen in klinischen Studien geprüft, die Proteine inhibieren und modulieren, die auf dem Boden derartiger Mutationen entstehen, wie zum Beispiel Inhibitoren der Isocitrat-Dehydrogenasen (IDH) bei Patienten mit Mutationen im IDH1- oder IDH2-Gen oder Inhibitoren von Proteinen des Spliceosom-Apparates bei Patienten, die Mutationen in einem für das Spliceosom relevanten Gen (z. B. SRSF2, U2AF1, SF3B1) aufweisen.
Der Einsatz von Genmutationen als Marker der minimalen Resterkrankungen hat einen festen Stellenwert insbesondere im Kontext der allogenen Stammzelltransplantation, wobei die Elimination der Mutation oder des Mutationsspektrums des Empfängers (Patient) eine komplette Remission bzw. eine Rekonstitution der Hämatopoese aus Spenderstammzellen anzeigt.
Durchflusszytometrie
Die Durchflusszytometrie (engl.: Fluorescence activated cell sorting, FACS) hat einen festen Stellenwert in der diagnostischen Abklärung von Zytopenien und der Diagnostik der MDS. Eine der wesentlichen Beiträge des FACS liegt im Ausschluss anderer Ursachen für die Zytopenie, wie einer Haarzell-Leukämie oder eines malignen Lymphoms. Darüber hinaus kann das FACS hilfreiche Hinweise liefern, wenn der medulläre Blastenanteil zytomorphologisch schwer zu bestimmen ist. Bei fortgeschrittenen MDS kann ein charakteristischer „Leukämie-assoziierter Immunphänotyp (LAIP)“ als Verlaufsparameter z. B. im Rahmen einer demethylierenden Therapie oder einer klassischen Induktionschemotherapie herangezogen werden.
Histologie
Zur initialen Komplettdiagnostik sollte immer auch eine Knochenmark-Histologie durchgeführt werden, die im Falle einer Punctio sicca ohnehin unentbehrlich und insbesondere in der differenzialdiagnostischen Abklärung einer Zytopenie von entscheidender Bedeutung ist: Die Frage nach einer Knochenmark-Infiltration durch ein Lymphom oder einer Knochenmark-Karzinose lässt sich oft nur durch eine histopathologische Begutachtung sicher klären. Zudem ist die Beurteilung der Zellularität insbesondere in der Abgrenzung eines hypoplastischen MDS von einer aplastischen Anämie eine Domäne der Histologie. Auch Fragen nach einer etwaigen Knochenmark-Fibrose in der Differenzialdiagnose zu den myeloproliferativen Neoplasien sowie der Nachweis/Ausschluss von Mastzellinfiltraten im Sinne eines MDS im Kontext einer systemischen Mastozytose mit begleitender Nicht-Mastzell-Erkrankung lassen sich Knochenmark-histologisch am sichersten abklären.
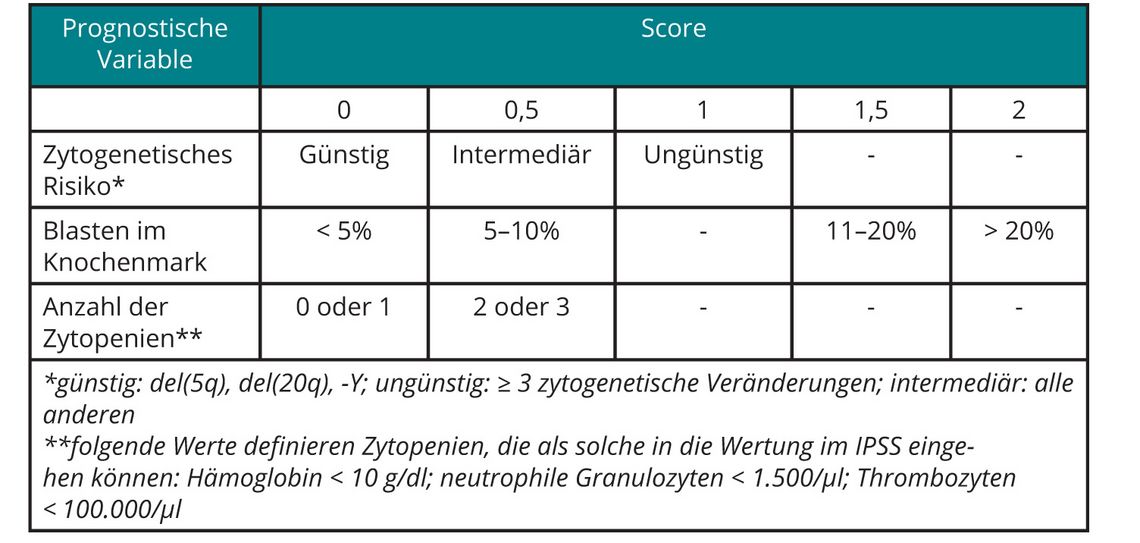
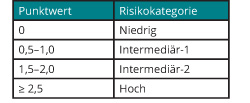
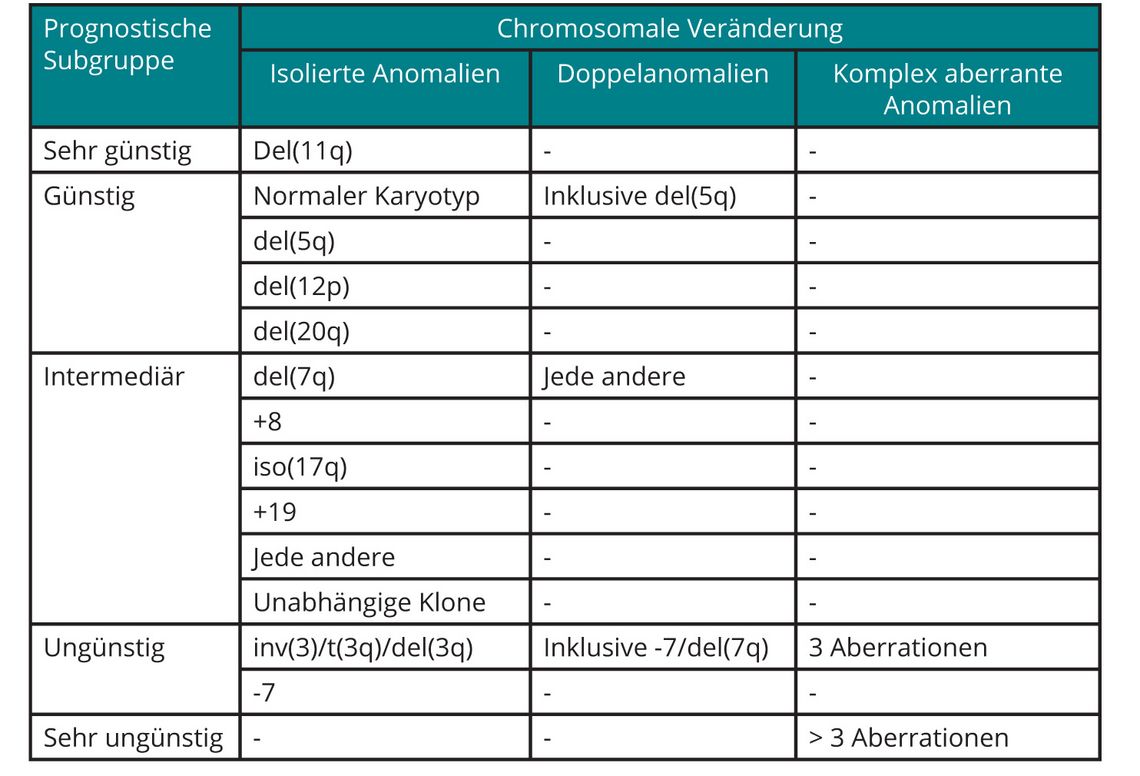
Risikostratifizierung
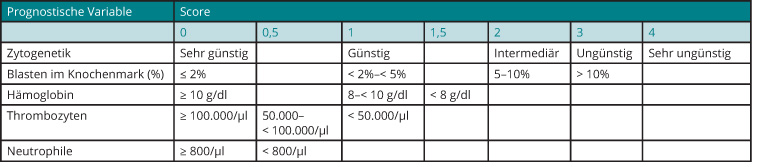
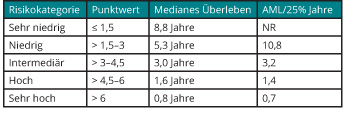
In das über viele Jahre eingesetzte „Internationale Prognostic Scoring System (IPSS)“ gingen neben dem medullären Blastenanteil und der Anzahl der Zytopenien auch zytogenetische Befunde ein, wobei die Wichtung der Parameter eindeutig zugunsten des medullären Blastenanteils ausfiel ([8]; s. Tab. 2). Nachdem die prognostische Relevanz auch seltenerer zytogenetischer Veränderungen an einer großen Zahl von MDS-Patienten gezeigt werden konnte, wurde auch der deutlich stärkere Einfluss des Karyotyps auf die Prognose der Patienten im Vergleich zum Blastenanteil im Knochenmark deutlich ([9]; s. Tab. 3). Vor diesem Hintergrund wurde im Jahr 2012 eine revidierte Version des IPSS vorgestellt (IPSS-R), dem eine wesentlich differenziertere prognostische Wichtung von Karyotyp-Veränderungen, insbesondere auch im Verhältnis zum medullären Blastenanteil, zugrunde liegt ([10]; s. Tab. 4).
Um einer Überschätzung des Krankheitsrisikos vorzubeugen, sollte bei der Beratung von Patienten berücksichtigt werden, dass sich die angegebenen Zeiten für das Gesamtüberleben und die Zeit bis zur Progression in eine AML beim IPSS und dem IPSS-R im Falle des Gesamtüberlebens auf 50% der Patienten bezieht, während bei der AML-Transformation die Zeit angegeben wird, bis 25% der Patienten eine AML entwickelt haben.
Therapie
Transfusionen
Nach wie vor ist die wesentliche Säule in der Betreuung von Patienten mit MDS die regelmäßige und am Bedarf der Patienten orientierte Transfusion von Erythrozytenkonzentraten (EK). Feste Grenzen für Hämoglobin- bzw. Thrombozyten-Werte lassen sich nicht allgemein gültig festlegen, sondern sollten vom subjektiven Empfinden der Patienten sowie eventuell bestehenden Komorbiditäten abhängig gemacht werden. Die maximale Rekompensation von Begleiterkrankungen (Lungenerkrankungen, Herzerkrankungen etc.) muss einen wichtigen Teil in der Gesamttherapie einnehmen.
Zwar ist im Gegensatz zur regelmäßigen Transfusion von Thrombozytenkonzentraten das Risiko einer Alloimmunisierung bei EK-polytransfundierten Patienten verhältnismäßig gering, dennoch liegen Berichte über Alloimmunisierungen, die überwiegend das Rhesus- und das Kell-System betreffen, in 15–20% transfundierter MDS-Patienten vor [11]. Obwohl bisher keine eindeutigen Empfehlungen bezüglich eines transfusionsmedizinischen und immunhämatologischen Managements von transfusionsbedürftigen MDS-Patienten vorliegen, sollte erwogen werden, das immunhämatologische Transfusionsregime vor Ersttransfusion eines MDS-Patienten mit einer Fachabteilung abzusprechen.
Eisenchelation
Wenige Bereiche in der Therapie der MDS werden so kontrovers diskutiert wie die klinische Relevanz der transfusionsbedingten Eisenüberladung und der Einfluss einer konsequenten Eisenchelation auf die Morbidität und Mortalität behandelter Patienten. Im Gegensatz zu Patienten mit MDS darf für Patienten mit angeborenen Anämien als belegt gelten, dass die Einführung einer wirksamen Eisenchelation einen eindeutig positiven Einfluss auf die krankheitsspezifische Morbidität und Mortalität hatte. Die organschädigende Wirkung einer Eisenüberladung wird erklärt durch das Auftreten von sogenanntem labilem Plasma-Eisen (engl. labile plasma iron, LPI), sobald das Transferrin gesättigt ist. Das LPI katalysiert die Bildung freier Hydroxyl-Radikale, die durch Oxidation Membranen von Zellen und Organellen schädigen und zu DNA-Schäden führen [12].
Aktuell finden vor allem zwei Eisenchelatoren klinische Anwendung: das parenteral verabreichbare Deferoxamin und der oral verfügbare Eisenchelator Deferasirox. Für beide konnte gezeigt werden, dass sie in der Lage sind, das Serum-Ferritin zu senken und auch das Organ-Eisen aus Leber und Herz zu mobilisieren. Bisher liegen jedoch keine prospektiv randomisierten Studien vor, die den klinischen Nutzen einer Eisenchelation bei MDS-Patienten hätten zeigen können. Ergebnisse einiger prospektiver Beobachtungsstudien legen nahe, dass eine konsequente Eisenchelation sowohl die Mortalität senkt als auch mit einem geringeren Transformationsrisiko assoziiert ist. Allerdings fallen in den Studien zum Teil Dysbalancen bezüglich der Patienten- und Krankheitscharakteristika zwischen den verglichenen Populationen auf, sodass ein Bias zugunsten der Patienten, die eine konsequente Eisenchelation erhalten hatten, möglich ist. Als Ausdruck der unklaren Datenlage hinsichtlich der Eisenchelation bei MDS-Patienten können auch die sehr unterschiedlichen Therapieempfehlungen der verschiedenen nationalen wie internationalen MDS-Gruppen dienen.
Inwiefern die Behandlung einer transfusionsbedingten Eisenüberladung vor Durchführung einer allogenen Stammzelltransplantation zu einer Reduktion der Transplantations-assoziierten Morbidität und Mortalität führt, wird aktuell in einer klinischen Studie geprüft.
Hämatopoetische Wachstumsfaktoren
Erythropoetin
Die Wirksamkeit von verschiedenen rekombinanten Erythropoetinen wurde bisher in verschiedenen unverblindeten und einarmigen Studien gezeigt. Zuletzt wurden Ergebnisse einer prospektiven, randomisierten, doppel-blinden Studie zu Darbepoetin vorgelegt, wobei sich eine signifikante Reduktion des Transfusionsbedarfs im Vergleich zu Placebo zeigte. Darüber hinaus wurde Epoetin alfa kürzlich zur Behandlung von Patienten mit Niedrigrisiko-MDS zugelassen.
Präferenziell sprechen jene Patienten auf eine solche Behandlung an, die einen niedrigen endogenen Erythropoetin-Spiegel (< 200 U/l) und eine niedrige Transfusionsfrequenz (< 2 EK pro Monat) aufweisen.
Unter der Annahme eines synergistischen Effektes auf die Erythropoese legten einige kleinere Studie den kombinierten Einsatz von Erythropoetin und Granulozyten-Kolonie-stimulierendem Faktor (engl.: Granulocyte-Colony Stimulating Factor, G-CSF) insbesondere bei anämischen MDS-Patienten mit Nachweis von Ringsideroblasten nahe. Aktuellere Studien mit größeren Fallzahlen konnten diesen Synergismus jedoch nicht nachvollziehen [13] und prospektive, randomisierte Studien hierzu fehlen, sodass eine solche Kombination aktuell nicht eindeutig empfohlen werden kann.
Granulozyten-Kolonie-stimulierender Faktor (G-CSF)
Bezüglich des Einsatzes von G-CSF zur Behandlung von Patienten mit schwerer Neutropenie konnte bisher nicht eindeutig belegt werden, das Patienten hiervon im Sinne einer Verringerung der Infekt-assoziierten Mortalität profitieren, was u. U. auch mit einem funktionellen Defekt der myeloischen Effektorzellen zusammenhängt [14].
Thrombopoetinrezeptor-Agonisten
Etwa 10% der MDS-bedingten Todesfälle werden kausal mit schweren Thrombozytopenien in Verbindung gebracht [15, 16]. Derzeit stehen zwei Thrombopoetinrezeptor-Agonisten für Patienten mit Immunthrombozytopenie zur Verfügung: Eltrombopag als oral verfügbarer und Romiplostim als subkutan zu applizierender Agonist.
Romiplostim wurde unter anderem in einer internationalen, randomisierten Phase-III-Studie bei Patienten mit Niedrigrisiko-MDS untersucht [17]. Dabei zeigten ca. 50% der Patienten ein thrombozytäres Ansprechen auf die Therapie. Aufgrund von Sicherheitsbedenken wegen eines beobachteten Anstiegs des medullären Blastenanteils bei einigen Patienten wurde die Rekrutierung frühzeitig beendet. In den weiteren Verlaufsuntersuchungen stellte sich der Anstieg des Blastenanteils als transient heraus, im Sinne einer unspezifischen Stimulation der Myelopoese durch Romiplostim, sodass man inzwischen davon ausgehen kann, dass bei Patienten mit MDS unter Romiplostim kein erhöhtes Transformationsrisiko besteht.
Lenalidomid
Der Thalidomid-Abkömmling Lenalidomid ist in Deutschland für Patienten zugelassen, die aufgrund eines MDS mit Niedrig- oder Intermediär-1-Risiko transfusionsbedürftig sind und eine isolierte Deletion auf dem langen Arm von Chromosom 5 aufweisen. Das heißt, Patienten mit einem Blastenanteil von bis zu 10%, aber ohne zusätzliche chromosomale Aberration dürfen mit der Substanz behandelt werden. Zu beachten ist, dass es gerade zu Beginn der Therapie, die in der Regel mit 10 mg p. o. einmal täglich begonnen wird, schwere Panzytopenien auftreten können, die ggf. eine Pausierung der Therapie und eine Dosisanpassung im Verlauf notwendig machen. Ca. 60–70% der oft hochgradig transfusionsbedürftigen Patienten werden im Verlauf transfusionsfrei [18]. Bisher geht man davon aus, dass die Therapie lebenslang fortzuführen ist. Eigene Erfahrungen und publizierte Fallberichte zeigen jedoch, dass auch Patienten, die die Therapie aus verschiedenen Gründen beenden müssen, dauerhaft transfusionsfrei bleiben können [19].
Demethylierende Substanzen
Patienten mit Intermediär-2- und Hochrisiko-MDS, die für eine allogene Stammzelltransplantation nicht geeignet sind, können eine Therapie mit der demethylierenden Substanz 5-Azacitidin erhalten. Im Vergleich zur reinen supportiven Therapie (inklusive Hydroxyurea) hatten Patienten unter 5-Azacitidin in der Phase-III-Zulassungsstudie ein signifikant verlängertes Überleben [20].
5-Azacitidin wird subkutan an sieben Tagen eines 28-Tage-Zyklus gegeben. Zwar wurde 5-Azacitidin in der Zulassungsstudie an den ersten sieben aufeinanderfolgenden Tagen gegeben, allerdings wird die Therapie aus Gründen der Praktikabilität oft auch im sogenannten 5 + 2 + 2-Schema appliziert (d. h., zunächst fünf Tage hintereinander von montags bis freitags, dann folgen zwei Tage Pause am Wochenende, und die Therapietage 6 und 7 werden in der Folgewoche am Montag und Dienstag gegeben). Nach den zurzeit vorliegenden Daten ist die Therapie so lange fortzuführen, bis es zum Therapieversagen kommt, inakzeptable Toxizitäten auftreten oder die Therapie auf Wunsch des Patienten beendet wird.
Typische unerwünschte Nebenwirkungen sind neben der Myelosuppression (gerade zu Beginn der Therapie) Übelkeit sowie flächenhafte Hautrötungen um die Einstichstellen. Diese scheinen durch intrakutan eingedrungenes 5-Azacitidin verursacht zu werden und können minimiert werden, indem die Punktionskanüle vor Injektion nicht von Luft entleert wird. Anekdotische Berichte deuten auf eine mildernde Wirkung von Kühlung oder Auftragen von Nachtkerzen-Öl auf die Punktionsstellen hin.
Allogene Stammzelltransplantation
Die allogene Stammzelltransplantation stellt das bisher einzige potenziell kurative Verfahren in der Behandlung der MDS dar. Mit der Verbesserung supportiver Maßnahmen bzw. einer Reduktion der Intensität der Konditionierung ist es in den vergangenen Jahren gelungen, die Indikationsstellung auch auf Patienten bis zu 70 Jahre zu erweitern. Trotzdem bleibt dieses Verfahren immer ein individuelles Vorgehen insbesondere bei über 60-jährigen Patienten. Vor allem Patienten mit einem Hochrisiko-MDS sollten – sofern eine Transplantation generell erwogen wird – zur Mitbeurteilung in einem Transplantationszentrum vorgestellt werden.
Innovative Therapieoptionen
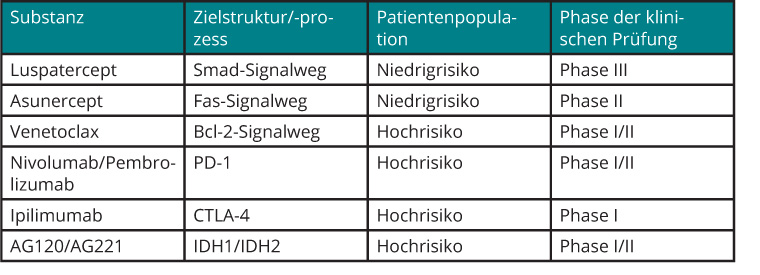
Eine unkontrollierte Aktivierung des Transforming-Growth-Factor-ß-Signaltransduktionswegs (TGF-β), insbesondere unter Involvierung des sogenannten Smad2-Proteins, ist mit einer gesteigerten Apoptose und verminderten Differenzierung erythroider Vorläuferzellen assoziiert. Luspatercept ist ein Fusionsprotein, das mit Liganden der TGF-β-Rezeptor-Familie interagiert und eine Bindung der Liganden an ihre Rezeptoren verhindert, wodurch deren Aktivierung unterbunden wird. Es wird subkutan appliziert und hat in klinischen Phase-II-Studien hohe Ansprechraten bei transfusionsbedürftigen Patienten mit Niedrigrisiko-MDS gezeigt, wobei präferenziell Patienten mit Nachweis von Ringsideroblasten ansprachen. Die Rekrutierung einer Placebo-kontrollierten, randomisierten Phase-III-Studie mit der Substanz ist abgeschlossen.
Wie bereits erwähnt wird eine gesteigerte Apoptose erythroider Vorläuferzellen als mitursächlich für die bei der Mehrzahl der MDS-Patienten bestehende Anämie angesehen. Asunercept inhibiert die Interaktion des Apoptose-induzierenden Fas-Liganden mit seinem Rezeptor. In einer Phase-I/II-Studie konnte die sehr gute Verträglichkeit der Substanz, die einmal wöchentlich intravenös appliziert wird, gezeigt werden. Darüber hinaus fanden sich Hinweise auf ein erythroides Ansprechen bei einigen der behandelten Patienten.
Das oral applizierbare und für die Therapie der CLL bereits zugelassene Venetoclax greift ebenfalls in die gestörte Apoptose-Regulation ein, indem es das anti-apoptotisch wirkende Protein Bcl-2 inhibiert. Unter der Vorstellung, dass bei Patienten mit fortgeschrittenem MDS eine Dysbalance zugunsten anti-apoptotischer Einflüsse besteht, wird Venetoclax derzeit in verschiedenen Phase-II-Studien auch bei Patienten mit Hochrisiko-MDS untersucht.
Tab. 5 führt eine Auswahl von innovativen Substanzen auf, die in verschiedenen Phasen der klinischen Entwicklung stehen.
Summary
Myelodysplastic syndromes – clinical practice and innovative therapeutic concepts
High-throughput techniques such as ultra-deep sequencing have revealed the molecular complexity of myelodysplastic syndromes (MDS) and established a new and more differentiated pathogenetic model of MDS. MDS are regarded as rather oligoclonal then monoclonal stem-cell diseases that are characterized by co-existence of different molecularly altered neoplastic clones. This has resulted in the incorporation of the disease-defining mutation of the SF3B1-Gen in the current WHO-classification, highlighting the necessity of using molecular methods in the diagnostic work-up in patients suspicious of having MDS. Therapeutic options for patients with MDS are still limited. However, identification of processes that can be pharmacologically targeted has led to the initiation of several clinical trials investigating new drugs that address deregulated signal transduction pathways and aberrant protein functions that have their origin in specific gene mutations.
Keywords: Myelodysplastic syndrome, molecular genetics, therapy, clinical trials
Literatur
1. Germing U et al. Epidemiology, classification and prognosis of adults and children with myelodysplastic syndromes. Ann Hematol 2008; 87: 691-9.
2. Medyouf H et al. Myelodysplastic cells in patients reprogram mesenchymal stromal cells to establish a transplantable stem cell niche disease unit. Cell Stem Cell 2014; 14: 824-37.
3. Warlick ED, Miller JS. Myelodysplastic syndromes: The role of the immune system in pathogenesis. Leuk Lymphoma 2011; 52: 2045-9.
4. Kerbauy DB, Deeg HJ. Apoptosis and antiapoptotic mechanisms in the progression of myelodysplastic syndrome. Exp Hematol 2007; 35: 1739-46.
5. Haferlach T et al. Landscape of genetic lesions in 944 patients with myelodysplastic syndromes. Leukemia 2014; 28: 241-7.
6. Mossner M et al. Mutational hierarchies in myelodysplastic syndromes dynamically adapt and evolve upon therapy response and failure. Blood 2016; 128: 1246-59.
7. Arber DA et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127: 2391-405.
8. Greenberg P et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89: 2079-88.
9. Schanz J et al. New comprehensive cytogenetic scoring system for primary myelodysplastic syndromes (MDS) and oligoblastic acute myeloid leukemia after MDS derived from an international database merge. J Clin Oncol 2012; 30: 820-9.
10. Greenberg PL et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood 2012; 120: 2454-65.
11. Sanz C et al. Red blood cell alloimmunization in transfused patients with myelodysplastic syndrome or chronic myelomonocytic leukemia. Transfusion 2013; 53: 710-5.
12. Gattermann N, Rachmilewitz EA. Iron overload in MDS-pathophysiology, diagnosis, and complications. Ann Hematol 2011; 90: 1-10.
13. Park S et al. Predictive factors of response and survival in myelodysplastic syndrome treated with erythropoietin and G-CSF: The GFM experience. Blood 2008; 111: 574-82.
14. Schmidt CS et al. Phenotypic and functional characterization of neutrophils and monocytes from patients with myelodysplastic syndrome by flow cytometry. Cell Immunol 2016; 308: 19-26.
15. Kantarjian H et al. The incidence and impact of thrombocytopenia in myelodysplastic syndromes. Cancer 2007; 109: 1705-14.
16. Neukirchen J et al. Platelet counts and haemorrhagic diathesis in patients with myelodysplastic syndromes. Eur J Haematol 2009; 83: 477-82.
17. Giagounidis A et al. Results of a randomized, double-blind study of romiplostim versus placebo in patients with low/intermediate-1-risk myelodysplastic syndrome and thrombocytopenia. Cancer 2014; 120: 1838-46.
18. Fenaux P et al. A randomized phase 3 study of lenalidomide versus placebo in RBC transfusion-dependent patients with Low-/Intermediate-1-risk myelodysplastic syndromes with del5q. Blood 2011; 118: 3765-76.
19. Giagounidis A et al. Long-term transfusion independence in del(5q) MDS patients who discontinue lenalidomide. Leukemia 2012; 26: 855-8.
20. Fenaux P et al. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: A randomised, open-label, phase III study. Lancet Oncol 2009; 10: 223-32.


PD Dr. med. Florian Nolte (korr. Autor)
Prof. Dr. med. Wolf-Karsten Hofmann
III. Medizinische Klinik, Hämatologie und
Internistische Onkologie,
Universitätsmedizin Mannheim
Theodor-Kutzer-Ufer 1–3, 68167 Mannheim

